
题目列表(包括答案和解析)
( 15 分)
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示)。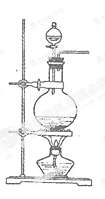
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_(填序号)
A.往烧瓶中加人MnO2粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是 。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为 mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3 ) = 2.8×10-9、Ksp(MnCO3 ) = 2.3×10-11
④ 进行丁方案实验:装置如图所示(夹持器具已略去)。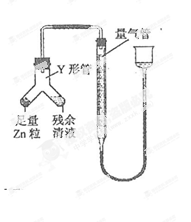
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是_(排除仪器和实验操作的影响因素)。
(15分)工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol·L-1NaOH溶液中得到漂白水。某同学想在实验室探究Cl2性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。
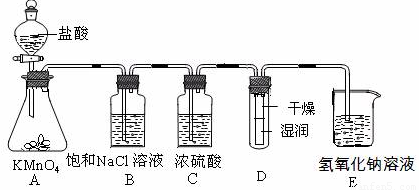
(1)配制物质的量浓度为0.375 mol·L-1NaOH溶液100mL时, 用托盘天平称取所需的NaOH质量为 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应方程式为 。
(4)装置B中饱和NaCl溶液的作用是 。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因
;如需改进,请简述设计方案 (若认为合理。则此问可不作答)。
(6)氯元素含量为10%的漂白水溶液355g,其中含NaClO的物质的量为 mol。
(15分)工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol·L-1NaOH溶液中得到漂白水。某同学想在实验室探究Cl2性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。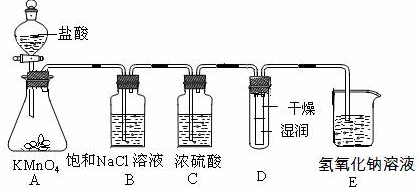
(1)配制物质的量浓度为0.375 mol·L-1NaOH溶液100mL时, 用托盘天平称取所需的NaOH质量为 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应方程式为 。
(4)装置B中饱和NaCl溶液的作用是 。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因
;如需改进,请简述设计方案 (若认为合理。则此问可不作答)。
(6)氯元素含量为10%的漂白水溶液355g,其中含NaClO的物质的量为 mol。
(15分)工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol·L-1NaOH溶液中得到漂白水。某同学想在实验室探究Cl2性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。
(1)配制物质的量浓度为0.375 mol·L-1NaOH溶液100mL时, 用托盘天平称取所需的NaOH质量为 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应方程式为 。
(4)装置B中饱和NaCl溶液的作用是 。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因
;如需改进,请简述设计方案 (若认为合理。则此问可不作答)。
(6)氯元素含量为10%的漂白水溶液355g,其中含NaClO的物质的量为 mol。
(15 分) S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
① CS2+3Cl2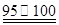 ℃CCl4+S2Cl2;② 2S+Cl2
℃CCl4+S2Cl2;② 2S+Cl2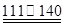 ℃S2Cl2。
℃S2Cl2。
已知:S2Cl2易与水反应,S2Cl2+Cl2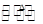 2SCl2。
2SCl2。
下列是几种物质的熔沸点和反应装置图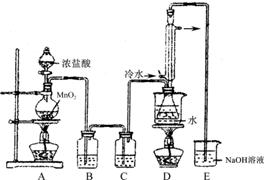
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com