
题目列表(包括答案和解析)
1L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、CO32-、Al(OH)4-(或AlO2-) |
Ⅰ、往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如下图所示.请回答下列问题:
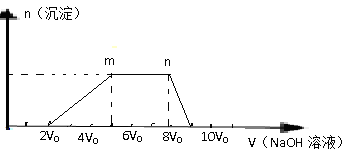
(1)该溶液中一定不存在的阳离子是 。
(2)该溶液中一定不存在的阴离子是 。
(3)m→n反应的的离子方程式为 。
(4)溶液中含有的阳离子对应的物质的量比为 。
Ⅱ、经检测,该溶液中还含有大量的Cl-、Br-、I-,向混合溶液中加入足量的氯化铁溶液,请写出有关反应的离子方程式 。
1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、Al(OH)4-(或AlO2-) |



 )与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中确定含有的离子有_______________;不能确定是否含有的阳离子有__________,要确定其存在可补充做的实验是________;
)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中确定含有的离子有_______________;不能确定是否含有的阳离子有__________,要确定其存在可补充做的实验是________;



 请根据以上流程,回答相关问题:
请根据以上流程,回答相关问题:| 化学式 | BaCO3 | BaSO4 | Ca SO4 | MgCO3 | Mg(OH)2 |
| Ksp | 8.1×10一9 | 1.08×10一10 | 1.9×10一4 | 3.5×10一5 | 1.6×10一11 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com