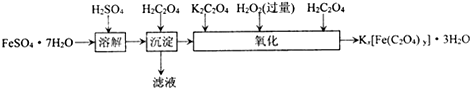
三草酸合铁(Ⅲ)酸钾晶体(K
3[Fe(C
2O
4)
3]?3H
2O)有很重要的用途.可用如下流程来制备.根据题意完成下列各题:
(1)若用铁和稀硫酸制备绿矾(FeSO
4?7H
2O)过程中,其中
(填物质名称)往往要过量,理由是
.
(2)要从溶液中得到绿矾,必须进行的实验操作是
.(按前后顺序填)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某兴趣小组为测定三草酸合铁酸钾晶体(K
3[Fe(C
2O
4)
3]?3H
2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H
2SO
4酸化,滴加KMnO
4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO
4-被还原成Mn
2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤3:在酸性条件下,用0.010mol/L KMnO
4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO
4溶液20.00ml,滴定中MnO
4-,被还原成Mn
2+.
(3)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有
;主要操作步骤依次是:称量、溶解、转移、
、定容、摇匀.
(4)步骤2中,加入锌粉的目的是
.
(5)步骤3中,发生反应的离子方程式为:
.
(6)步骤2中,若加入的KMnO
4的溶液的量不够,则测得的铁含量
.(选填“偏低”、“偏高”、“不变”)