本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
A.《物质结构与性质》:原子序数依次增大的X、Y、Z、W四种元素,原子序数均小于36.已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ?mol-1 |
I1 |
I2 |
I3 |
I4 |
| X |
496 |
4562 |
6912 |
9543 |
| Y |
738 |
1451 |
7733 |
10540 |
| Z |
578 |
1817 |
2745 |
11578 |
(1)X、Y、Z的电负性从大到小的顺序为
Al>Mg>Na
Al>Mg>Na
(用元素符号表示),元素Y的第一电离能大于Z的原因是
Y的最外层电子排布处于全满稳定状态,能量降低
Y的最外层电子排布处于全满稳定状态,能量降低
.
(2)W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O
2在体内的正常运输.已知W
2+与KCN溶液反应得W(CN)
2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示.
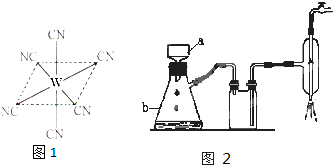
①W元素基态原子价电子排布式为
3d64s2
3d64s2
.
②已知CN
-与
N2
N2
分子互为等电子体,1molCN
-中π键数目为
2NA
2NA
.
③上述沉淀溶解过程的化学方程式为
Fe(CN)2+4KCN=K4[Fe(CN)6]
Fe(CN)2+4KCN=K4[Fe(CN)6]
.
B.《化学实验》:无色晶体硫酸锌,俗称皓矾,在医疗上用作收敛剂,工业上作防腐剂、制造白色颜料(锌钡白)等.某实验小组欲用制氢废液制备硫酸锌晶体,进行了以下实验:
(1)取50mL制氢废液,过滤.除去不溶性杂质后,用ZnO调节滤液使pH约等于2,加热、蒸发、浓缩制得较高温度下的硫酸锌饱和溶液,冷却结晶,得到粗制的硫酸锌晶体.
①加入少量氧化锌调节滤液使pH≈2目的是
将硫酸转化成硫酸锌除去硫酸,且不带进其他杂质
将硫酸转化成硫酸锌除去硫酸,且不带进其他杂质
;
②加热蒸发、浓缩溶液时,应加热到
溶液表面出现晶膜
溶液表面出现晶膜
时,停止加热.
(2)粗晶体在烧杯中用适量蒸馏水溶解,滴加1~2滴稀硫酸,用沸水浴加热至晶体全部溶解.停止加热,让其自然冷却、结晶.抽滤(装置如图2所示).将所得晶体用少量无水乙醇洗涤1-2次,得到较纯的硫酸锌晶体.
①写出下列仪器的名称.a
布氏漏斗
布氏漏斗
;b
吸滤瓶
吸滤瓶
.
②抽滤跟普通过滤相比,除了得到沉淀较干燥外,还有一个优点是
过滤速度快
过滤速度快
.
③用少量无水乙醇洗涤晶体的目的是
利用乙醇的挥发,除去晶体表面附着的水分,减少硫酸锌的损失
利用乙醇的挥发,除去晶体表面附着的水分,减少硫酸锌的损失
.
(3)在制取氢气时,如果锌粒中混有少量的铁、铜杂质,对硫酸锌的质量
无
无
(填“有”、“无”)影响,原因是
铜不与稀硫酸反应,过滤除去;铁虽然与稀硫酸反应生成硫酸亚铁,但锌比铁活泼,只要锌粒过量,就可置换硫酸亚铁中铁过滤除去
铜不与稀硫酸反应,过滤除去;铁虽然与稀硫酸反应生成硫酸亚铁,但锌比铁活泼,只要锌粒过量,就可置换硫酸亚铁中铁过滤除去
.