
题目列表(包括答案和解析)
已知有机物F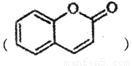 是一种存在于某些植物的果、花等中的天然香料。又知:
是一种存在于某些植物的果、花等中的天然香料。又知:
(i)乙酸酐的结构为 
(ii)同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基;
(iii)工业上常用有机物G制取有机物F:

某化学小组以有机物A(A是苯的同系物,分子式为C7H8;B中有五种不同化学环境的氢;C可与FeCl3溶液发生显色反应)为原料制取F的合成路线(部分反应条件及副产物已略去)如下:

(1)有机物G中的含氧官能团为 和 (填官能团名称)。 G的分子式为 。
(2)A的化学名称为 。由C生成D的反应类型为 。
(3)由B生成C的化学方程式为 。
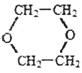
(4)写出同时满足下列条件的E的一种同分异构体的结构简式: 。
Ⅰ.属于芳香族化合物;Ⅱ.苯环上有两个取代基;Ⅲ.核磁共振氢谱图上有4个吸收峰;IV.能发生银镜反应。
(5)请写出以乙醇(CH3CH20H)为原料制备 (是一种常用的有机溶剂)的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
(是一种常用的有机溶剂)的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

已知有机物F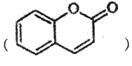 是一种存在于某些植物的果、花等中的天然香料。又知:
是一种存在于某些植物的果、花等中的天然香料。又知:
(i)乙酸酐的结构为 ![]()
![]()
(ii)同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基;
(iii)工业上常用有机物G制取有机物F:
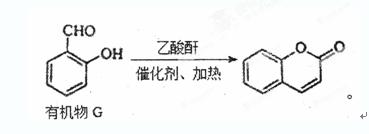
某化学小组以有机物A(A是苯的同系物,分子式为C7H8;B中有五种不同化学环境的氢;C可与FeCl3溶液发生显色反应)为原料制取F的合成路线(部分反应条件及副产物已略去)如下:
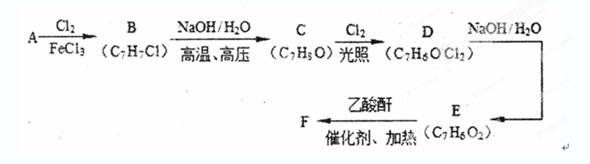
(1)有机物G中的含氧官能团为 和 (填官能团名称)。 G的分子式为 。
(2)A的化学名称为 。由C生成D的反应类型为 。
(3)由B生成C的化学方程式为 。
(4)写出同时满足下列条件的E的一种同分异构体的结构简式: 。
 Ⅰ.属于芳香族化合物;Ⅱ.苯环上有两个取代基;Ⅲ.核磁共振氢谱图上有4个吸收峰;IV.能发生银镜反应。
Ⅰ.属于芳香族化合物;Ⅱ.苯环上有两个取代基;Ⅲ.核磁共振氢谱图上有4个吸收峰;IV.能发生银镜反应。
(5)请写出以乙醇(CH3CH20H)为原料制备 (是一种常用的有机溶剂)的合成路线流程
图(无机试剂任用)。合成路线流程图示例如下:
![]()
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面。A、B两种元素组成的原子个数比为1︰1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)下列叙述正确的是 (填字母)。
a.M易溶于水,是因为M与水分子间能形成氢键,且M是极性分子;N不溶于水,是因为N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和3个π键
d.BD2晶体的熔沸点都比二氧化硅晶体的低
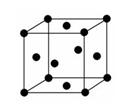
(2)金属E的晶胞是面心立方结构(如图),则E晶体的1个晶胞中E原子数为:__ __,E原子的配位数为:__ __。
(3)E的一种氧化物化学式为EO2,广泛用于制造高级白色油漆,也是许多反应的催化剂。工业上用含E的矿石[主要成分为FeEO3(不溶于水) ]作原料制取EO2。矿石经过硫酸溶液浸泡,生成含EO2+的溶液,再经稀释得EO2·xH2O,写出这两步反应的离子方程式 , 。
(4)X和Y分别是B和C的氢化物,这两种氢化物都含有18电子。X和Y的化学式分别是 、 。两者沸点的关系为X Y(>,或<),原因是 。
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面。A、B两种元素组成的原子个数比为1︰1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)下列叙述正确的是 (填字母)。
a.M易溶于水,是因为M与水分子间能形成氢键,且M是极性分子;N不溶于水,是因为N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和3个π键
d.BD2晶体的熔沸点都比二氧化硅晶体的低
(2)金属E的晶胞是面心立方结构(如图),则E晶体的1个晶胞中E原子数为:__  __,E原子的配位数为:__ __。
__,E原子的配位数为:__ __。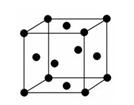
(3)E的一种氧化物化学式为EO2,广泛用于制造高级白色油漆,也是许多反应的催化剂。工业上用含E的矿石[主要成分为FeEO3(不溶于水) ]作原料制取EO2。矿石经过硫酸溶液浸泡,生成含EO2+的溶液,再经稀释得EO2·xH2O,写出这两步反应的离子方程式 ,  。
。
(4)X和Y分别是B和C的氢化物,这两种氢化物都含有18电子。X和Y的化学式分别是 、 。两者沸点的关系为X Y(>,或<),原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com