
题目列表(包括答案和解析)
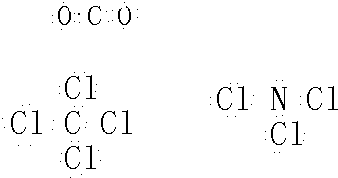
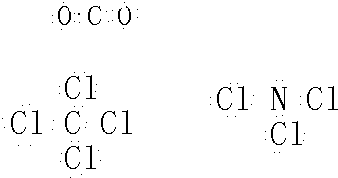
| |||||||||||||||||||
| ||
| ||
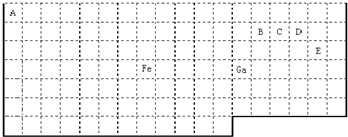
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物。
① CO可以和很多过渡金属形成配合物。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO中中心原子的杂化类型为 杂化,与CO互为等电子体的分子和离子有(各写一种): 、 。
② Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
③ Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 ,得到新的配合物有 种
④ 配合物 分子内的作用力有 (填编号)。
分子内的作用力有 (填编号)。
A.氢键 B.离子键 C.共价键 D.配位键
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
 ⑤ 镓原子的基态电子排布式是 。比较第一电离能Ga Zn(填 “>”、“=”、“<”),说明理由
⑤ 镓原子的基态电子排布式是 。比较第一电离能Ga Zn(填 “>”、“=”、“<”),说明理由
(3)铜是是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。
⑥ CuH的晶体结构如图所示,该晶体中Cu+的配位数为 。CuH具有许多特殊性质,如易分解、能与水反应、在氯气中燃烧等。写出CuH在氯气中燃烧的化学方程式 。
(10分) ![]() 生物相容性好、抗凝血性优良的纳米医用材料的分子设计、合成、表征及其在生物体内构效关系与机理研究,是当今世界材料、生物、医学、药学及其相关交叉学科研究领域的前沿。聚氨酯(Polyurethane,PU)指的是主链上含有氨基甲酸酯(-NHCOO-)特征基团的一类高聚物,由多异氰酸酯与聚醚型或聚酯型多元醇反应制得(-N=C=O + HO → -NHCOO-), 聚氨酯弹性体兼具良好的生物稳定性和抗凝血性,大量的聚醚型聚氨酯被用作人工心脏瓣膜、人造血管等医用材料。
生物相容性好、抗凝血性优良的纳米医用材料的分子设计、合成、表征及其在生物体内构效关系与机理研究,是当今世界材料、生物、医学、药学及其相关交叉学科研究领域的前沿。聚氨酯(Polyurethane,PU)指的是主链上含有氨基甲酸酯(-NHCOO-)特征基团的一类高聚物,由多异氰酸酯与聚醚型或聚酯型多元醇反应制得(-N=C=O + HO → -NHCOO-), 聚氨酯弹性体兼具良好的生物稳定性和抗凝血性,大量的聚醚型聚氨酯被用作人工心脏瓣膜、人造血管等医用材料。
2004年日本化学家以4,4-二苯基甲烷二异氰酸酯(OCN-R-NCO,MDI)、聚四氢呋喃醚二醇(![]() )、三乙基胺[N(CH2CH3)3]、二羟甲基丙酸[HOCH2C(CH2OH)(CH3)CO2H](以上原料的物质的量比为4:2:1:1)为原料,经两步合成了一种带正电的羧氨两性离子修饰的PU纳米(APU)微乳液(如图1中示意图所示)。中国科学工作者,在此基础上得到了分布均匀的纳米粉末及其固体核磁图谱(见图1所示);证明了该纳米表面的结构;并进一步对其进行了磷酸化表面构建(如图2-3所示),得到带负电的纳米粒子(APU-PO43-)。该APU-PO43-纳米粒子粉体,其粒径分散窄,结构和性能稳定,并具有良好的生物相容性和抗凝血性能。
)、三乙基胺[N(CH2CH3)3]、二羟甲基丙酸[HOCH2C(CH2OH)(CH3)CO2H](以上原料的物质的量比为4:2:1:1)为原料,经两步合成了一种带正电的羧氨两性离子修饰的PU纳米(APU)微乳液(如图1中示意图所示)。中国科学工作者,在此基础上得到了分布均匀的纳米粉末及其固体核磁图谱(见图1所示);证明了该纳米表面的结构;并进一步对其进行了磷酸化表面构建(如图2-3所示),得到带负电的纳米粒子(APU-PO43-)。该APU-PO43-纳米粒子粉体,其粒径分散窄,结构和性能稳定,并具有良好的生物相容性和抗凝血性能。
医学研究工作者对此生物相容性好的纳米材料提出了希望:即在其内包入生物学示踪物Co,而使其能成为生物体内医用失踪材料。古希腊人曾将Co缓慢溶解在HCl中,利用其所得的化合物B制造有色玻璃;但在B溶液中NaOH,会先出现蓝色沉淀C,后出现粉红色沉淀D,最后慢慢转化为棕褐色E;在B溶液中滴加同浓度的氨水,会先出现蓝色沉淀C,后沉淀C溶解并最后慢慢转化为橙黄色溶液F; Co的金属有机化合物在有机合成和工业均相催化过程中有重要应用价值。如苯乙炔Co配合物,Co2(PhC2Ph)(CO)6 。
![]()

![]()

![]()

问题:根据上述条件
11-1 请写出带正电的APU 纳米微乳液的合成反应方程式;
11-2 回答常温条件下PO43-与APU纳米微乳液有几种可能结合方式,实验依据是什么?PO43-在APU纳米微乳液中最靠近那个基团(可以在图1 中标出)?
11-3 请写出B-F 物质的分子式;
B___________;C___________;D___________;E___________;F___________;
11-4 请画出配合物Co2 (PhC2Ph)(CO)6结构示意图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com