用数轴表示化学知识,并按某种共性对化学物质进行分类,有简明易记的效果.例如,根据碳素钢的含碳量,将其分为低碳钢、中碳钢和高碳钢,利用数轴的分类法可将其表示为
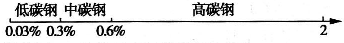
根据这一分类法回答下列问题:
(1)将pH与溶液酸碱性的关系粗略地表示在如下数轴上(常温下):
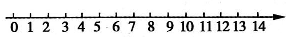
(2)某化学兴趣小组欲研究H
2SO
4、KCl、Na
2SO
3、Na
2CO
3、NaCl、NaOH的性质,对于如何研究,他们设计了两种方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验.
方案Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,边行实验.
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H
2SO
4溶液的pH小于7;Na
2SO
3、Na
2CO
3、NaOH溶液的pH大于7.由此有的同学按分类法思想把Na
2SO
3、Na
2CO
3与NaOH都划分为碱类,这样划分是否合理?为什么?
②在方案Ⅰ中,某同学发现盐类物质中的KCl和NaCl两种物质,它们在与其他物质混合时现象相同,无法区分,请你设计一种简单的方法区分这两种物质:
焰色反应透过钴玻璃呈紫色说明是氯化钾,焰色反应呈黄色为氯化钠
焰色反应透过钴玻璃呈紫色说明是氯化钾,焰色反应呈黄色为氯化钠
.
③在方案Ⅱ中,三种钠盐用其他化合物中的
H2SO4
H2SO4
可加以区分,有关反应的化学方程式分别为
H2SO4+Na2CO3=Na2SO4+CO2↑+H2O H2SO4+Na2SO3=Na2SO4+SO2↑+H2O
H2SO4+Na2CO3=Na2SO4+CO2↑+H2O H2SO4+Na2SO3=Na2SO4+SO2↑+H2O
.
④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na
2SO
3、Na
2CO
3、NaCl、NaOH和H
2SO
4、KCl两类.在用H
2SO
4鉴别四种含钠元素的物质时,Na
2SO
3和Na
2CO
3,很容易区分,但鉴别NaCl和NaOH时却陷入了困境,请你帮忙解决这一难题(试剂只限于上述六种物质):
在两支试管中分别加入少许硫酸溶液,分别加入稍过量的两种未知溶液,充分混合,再向混合液中分别滴入碳酸钠溶液,若有气泡生成,则加入的未知液为NaCl,若无气泡生成,则加入的未知液为NaOH溶液;
在两支试管中分别加入少许硫酸溶液,分别加入稍过量的两种未知溶液,充分混合,再向混合液中分别滴入碳酸钠溶液,若有气泡生成,则加入的未知液为NaCl,若无气泡生成,则加入的未知液为NaOH溶液;
.

 CO(g)+H2(g)△H=+131kJ?mol-1
CO(g)+H2(g)△H=+131kJ?mol-1 CH3OH(g) 据研究,给合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)
CH3OH(g) 据研究,给合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示) 2Cu+CO2
2Cu+CO2 2Cu+CO2
2Cu+CO2