
题目列表(包括答案和解析)
(12分)(2009·山东理综)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是___ _____________________________________________________________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn
c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是__________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
(12分)(2009·山东理综)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是___ _____________________________________________________________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn
c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是__________________。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
(8分)2009年“六·五”世界环境日,中国主题是“减少污染——行动起来”,这向世界传达了建设环境友好型社会的理念。已知反应:
①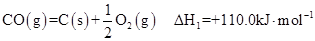
②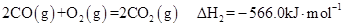
请回答下列问题:
(1)反应①的熵变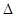 S (填“>”或“<”)0。
S (填“>”或“<”)0。
(2)有人建议,汽车尾气中的CO可用催化加热分解的方法来消除(反应①),这一方案在理论上是否可行? (填“可行”或“不可行”)。
(3)反应②中的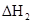 是不是CO的燃烧热?
(填“是”或“不是”)。
是不是CO的燃烧热?
(填“是”或“不是”)。
(4)煤炭的充分燃烧也是建设环境友好型社会的一个重要方面,12 g C(s)完全燃烧生成CO2(g)时,放出的热量为 kJ(依据反应①、②计算)。
(8分)2009年“六·五”世界环境日,中国主题是“减少污染——行动起来”,这向世界传达了建设环境友好型社会的理念。已知反应:
①![]()
②![]()
请回答下列问题:
(1)反应①的熵变![]() S (填“>”或“<”)0。
S (填“>”或“<”)0。
(2)有人建议,汽车尾气中的CO可用催化加热分解的方法来消除(反应①),这一方案在理论上是否可行? (填“可行”或“不可行”)。
(3)反应②中的![]() 是不是CO的燃烧热? (填“是”或“不是”)。
是不是CO的燃烧热? (填“是”或“不是”)。
(4)煤炭的充分燃烧也是建设环境友好型社会的一个重要方面,12 g C(s)完全燃烧生成CO2(g)时,放出的热量为 kJ(依据反应①、②计算)。
(8分)2009年“ 六·五”世界环境日,中国主题是“减少污染——行动起来”,这向世界传达了建设环境友好型社会的理念。已知反应:
六·五”世界环境日,中国主题是“减少污染——行动起来”,这向世界传达了建设环境友好型社会的理念。已知反应:
①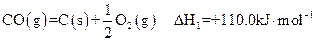
②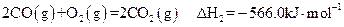
请回答下列问题:
(1)反应①的熵变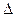 S (填“>”或“<”)0。
S (填“>”或“<”)0。
(2)有人建议,汽车尾气中的CO可用催化加热分解的方法来消除(反应①),这一方案在理论上是否可行? (填“可行”或“不可行”)。
(3)反应②中的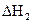 是不是CO的燃烧热? (填“是”或“
是不是CO的燃烧热? (填“是”或“ 不是”)。
不是”)。
(4)煤炭的充分燃烧也是建设环境友好型社会的一个重要方面,12 g C(s)完全燃烧生成CO2(g)时,放出的热量为 kJ(依 据反应①、②计算)。
据反应①、②计算)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com