
题目列表(包括答案和解析)
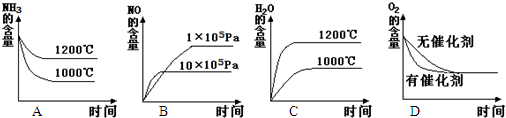
在1L密闭容器中发生反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-Q kJ?mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
|

| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 5.8 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 8.8 | 3.2 | 5.2 | 6.7 |
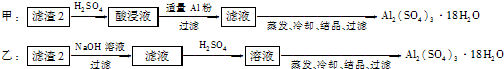
2- 3 |
2- 6 |
| 时间/浓度/(mol?L-1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第 2min | 3.2 | 4.5 4.5 |
0.8 | 1.2 |
| 第 4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第 6min | 2.0 | 3.0 | 2.0 | 3.0 |
工业上可以从电解铜的阳极泥中提取很多重要物质,其工艺流程如下:
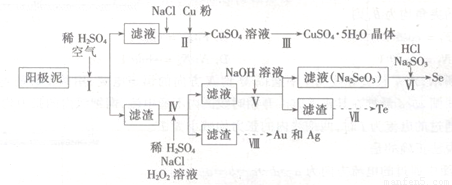
已知:①阳极泥的主要化学成分,如表1所示
表一
主要成份 | Cu??? Ag???? Au????? Se???? Te |
百分含量/% | 23.4??? 12.1???? 0.9???? 6.7???? 3.1 |
②温度和硫酸浓度对阳极泥中各组分浸出率的影响,如表2所示
表二
| 固定浸出温度 |
|
| 固定H2SO4浓度
|
H2SO4浓度 mol/L | 浸出率/% |
| 浸出温度/℃ | 浸出率/% |
Cu? Ag? Au? Se? Te |
| Cu? Ag? Au? Se? Te | ||
4 | 95.1 4.67? <0.2? 0.83 8.93 |
| 30 | 87.1 4.58? <0.2 0.08 6.83 |
3 | 94.5 4.65? <0.2? 0.28 6.90 |
| 40 | 94.5 4.65? <0.2? 0.28 6.90 |
2 | 78.1 2.65? <0.2? 0.05 2.85 |
| 50 | 96.1 5.90? <0.2? 0.64 8.73 |
(1)步骤I的主要目的为浸出铜,此过程中发生的主要反应的化学方程式为____________分析表2数据,可知步骤I最适合的条件为??????????????????? 。
(2)步骤Ⅱ中,加入Cu粉的目的是除去滤液中含碲的离子,加入NaCl的目的为____。
(3)步骤Ⅲ的操作方法为????????????????????? 。
(4)步骤Ⅳ中,反应温度为75℃。加入H2O2溶液的作用为?????????????????? ;此过程中H2O2溶液的添加量要远远高于理论值,原因为?????????????????? 。
(5)步骤Ⅵ中所发生反应的化学方程式为?????? ???????????????? 。
(6)步骤Ⅶ中,Te的获得可以通过碱性环境下电解Na2TeO3溶液实现,其阴极的电极反应式为 ???? 。
(7)步骤Ⅷ中得到的Au和Ag混合物可以用____进行分离(填选项字母)。
A.稀硝酸 ?? B.浓盐酸? ?? C.浓氢氡化钠溶液? ?? D.王水
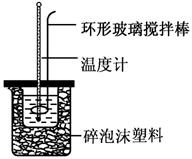
(共6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
|
实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是 。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH= [盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”、 “不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com