
题目列表(包括答案和解析)
海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:
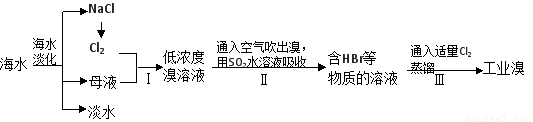
(1)可以用淀粉-KI试纸检验操作I中是否有溴生成,其操作方法是___________________。
(2)操作Ⅱ发生反应的离子方程式为_____________;可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为______。
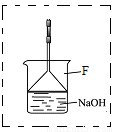
(3)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:

下表为苯、溴和溴苯的相关数据:
| 苯 | 溴 | 溴苯 |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
回答下列问题:
(4)在A中加入30 .0mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①在该实验中, B装置的名称是__________,A的容积最适合的是_________(填编号)
a.25mL????? b.50mL????? c.100mL??? d.250mL
②收集溴苯时,应根据_________(填“C1”或“C2”)所显示的温度,其温度应为_________。
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有_______________________(填化学式)。
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案__________(填“合理”或“不合理”),理由是__________________。
海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:
(1)可以用淀粉-KI试纸检验操作I中是否有溴生成,其操作方法是___________________。
(2)操作Ⅱ发生反应的离子方程式为_____________;可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为______。
(3)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:

下表为苯、溴和溴苯的相关数据:
| | 苯 | 溴 | 溴苯 |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
早在20世纪90年代,国际上提出了“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各环节能都实现净化和无污染的反应途径。
(1)下列各项属于“绿色化学”的是 。
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
(2)在我国西部大开发中,某省为筹建一大型化工基地,征集到下列方案,其中你认为可行的是 。
A.建在西部干旱区可以脱贫致富
B.应建在水资源丰富和交通方便的远离城市的郊区
C.企业有权自主选择厂址
D.不宜建在人口稠密的居民区
(3)坐落在山东沿海地区的潍坊纯碱厂是我国重点大型企业,其生产工艺沿用我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
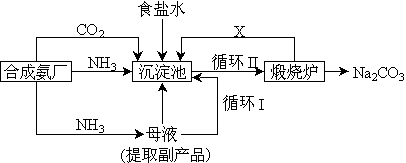
①上述生产纯碱的方法称 ,副产品的一种用途为 。
②沉淀池中发生的化学反应方程式是 。
③写出上述流程中X物质的分子式 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是 。
⑤母液中含有 ,(以化学式表示)。有向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
(a)增大NH4+的浓度,使NH4Cl更多地析出
(b)使NaHCO3更多地析出
(c)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度

| |||||||||||||||||||||||||||||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com