
题目列表(包括答案和解析)
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题:

①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是???????? 。
A.体系的密度不发生变化???? ????????????? ? B.SO2与SO3的体积比保持不变
C.体系中硫元素的质量百分含量不再变化??? ?? D.单位时间内转移4 mol 电子,同时消耗2 mol SO3
E.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

图1 ????? ? ? 图2?? ???? ? 图3
①该反应的平衡常数表达式为?????????? ,升高温度,平衡常数????????? (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)=??????? ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为??????? (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 ????? 点,温度T1 ?? T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈???? 性,所得溶液中c(H+)- c(OH-)=??????????? (填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图 所示,根据图回答下列问题:
所示,根据图回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”)。
2SO3(g)的△H__________0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

图1 图2 图3
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)- c(OH-)= (已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如右图所示,根据下图回答下列问题: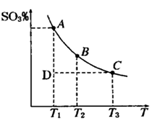
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
| A.体系的密度不发生变化 | B.SO2与SO3的体积比保持不变 |
| C.体系中硫元素的质量百分含量不再变化 | D.单位时间内转移4 mol 电子,同时消耗2 mol SO3 |
 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。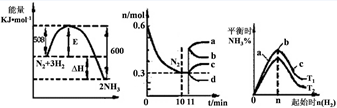
运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图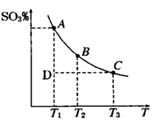 所示,根据图回答下列问题:
所示,根据图回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”)。
2SO3(g)的△H__________0(填“>”或“<”)。
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。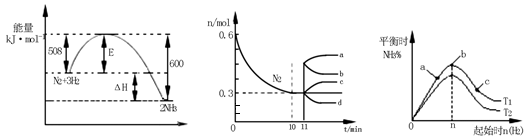
图1 图2 图3
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 。
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)- c(OH-)= (已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I—→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I—继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I—→2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
|
编号 |
往烧杯中加入的试剂及其用量(mL) |
催化剂 |
开始变蓝时间(min) |
||||
|
0.1 mol·Lˉ1 KI溶液 |
H2O |
0.01 mol·Lˉ1 X 溶液 |
0.1 mol·Lˉ1 双氧水 |
1 mol·Lˉ1 稀盐酸 |
|||
|
1 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
无 |
1.4 |
|
2 |
20.0 |
m |
10.0 |
10.0 |
n |
无 |
2.8 |
|
3 |
10.0 |
20.0 |
10.0 |
20.0 |
20.0 |
无 |
2.8 |
|
4 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
5滴Fe2(SO4)3 |
0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I—→2H2O+I2反应速率的影响。实验2中m= ,n= 。
(2)已知,I2与X反应时,两者物质的量之比为1∶2。按面表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X)~ t的变化曲线图(进行相应的标注)。

(4)实验3表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s) 2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。
2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com