
题目列表(包括答案和解析)
化工生产中用烷烃和水蒸气反应得到以CO和H2为主的混合气体.这种混合气体可用于生产甲醇或合成氨,对甲烷而言,有如下两个主要反应:
①CH4(g)+![]() O2(g)=CO(g)+2H2(g);ΔH1-36kJ/mol
O2(g)=CO(g)+2H2(g);ΔH1-36kJ/mol
②CH4(g)+H2O(g)=CO(g)+3H2(g);ΔH2=+216kJ/mol
由反应①、②推出总反应热为零的总反应方程式③,并求进料气中空气(O2的体积分数为21%)与水蒸气的体积比.
化工生产中用烷烃和氧气或水蒸气反应可得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨。对甲烷而言,有以下两个主要反应:
①CH4(g)+![]() O2(g)
O2(g) CO(g)+2H2(g);△H1=-36kJ?mol-1
②CH4(g)+H2O(g) CO(g)+3H2(g);△H2=+216kJ?mol-1
(1)反应②中参加反应的CH4(g)与H2O(g)的总能量 (填“大于”、“小于”或“等于”)生成的CO(g)与H2(g)的总能量。
(2)若氧气和水蒸气的混合气体中氧气的物质的量分数为x,请填写下列空白。
| 序号 |
| 反应①的 △H/(kJ?mol-1) | 反应②的 △H/(kJ?mol-1) | 总反应的 △H/(kJ?mol-1) |
| I | 0.2 | -18 | ||
| Ⅱ | -36 | +72 |
(3)若此化工厂生产中反应的能量在利用过程中不计损耗,为使能量实现零排放和零补充,则进料气中水蒸气与空气(O2的体积分数为20%)的体积之比为 。
能和资是维系人类发展的重要前提之一。目前人类使用的主要能还是化石燃料。请回答下列问题:
(1)化石燃料包括煤、石油、 (写出另外一种化石燃料的名称)。煤炭开采过程中,若采取的措施不当,容易发生瓦斯爆炸事故,导致生命财产损失,用化学方程式解释在煤矿中频频发生瓦斯爆炸的原因:
。
(2)煤的气化可以缓解石油危机,而目前煤的气化主要是煤中的碳和水蒸气的反应:C+H2O(g)===CO+H2,该反应是一个吸热反应,反应所需的能量一般是由间歇进行的碳的燃烧(氧气用空气代替)提供的:C+O2===CO2。
①有人认为上述第一个反应需要吸热,所以煤的气化从能量角度看,得不偿失。请你解释这种观点的错误所在:
。
②煤的气化可以为工业合成氨提供原料气。氢气于 ,氮气于 ,还可以采用 工艺得到空气中的氮气。
(3)我国煤炭资相对石油和天然气资丰富,煤制油有一定的资保障。煤液化的重要方法是间接液化法,首先将煤气化为H2、CO和CH4,然后通过催化剂将气态物质转化为液态。通过间接法制备的燃油中含有饱和烷烃和不饱和烯烃,请完成下列粗煤气合成烯烃和烷烃的化学方程式: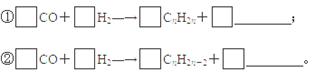
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com