
题目列表(包括答案和解析)
热化学方程式中的H实际上是热力学中的一个物理量,叫做焓.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态).
(1)化学反应中的ΔH是以________的形式体现的.对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为________0(填“大于”.“小于”),该反应是________(填“放热”或“吸热”)反应.
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关.
已知:298 K时,H2(g)+Cl2(g)=2HCl(g) ΔH=-185 kJ·mol-1 ΔH(H2)=436 kJ·mol-1,ΔH(Cl2)=247 kJ·mol-1.则ΔH(HCl)=________.
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关.这就是有名的“Hess定律”.
已知:Fe2O3(s)+3CO(g)=2Fe( s)+3CO2(g) ΔH=-25 kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19 kJ·mol-1
请写出CO还原FeO的热化学方程式________.
|
已知:2CH3OH(g) 某温度下的平衡常数为400.此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
下列说法正确的是 | |
| [ ] | |
A. |
平衡后升高温度,平衡常数>400 |
B. |
平衡时, c(CH3OCH3)=1.6 mol/L |
C. |
平衡时,反应混合物的总能量减少20 kJ |
D. |
平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大 |
热力学是专门研究能量相互转变过程中所遵循的法则的一门科学.在热力学研究中,为了明确研究的对象,人为地将所注意的一部分物质或空间与其余的物质或空间分开.被划分出来作为研究对象的这一部分称之为体系;而体系以外的其他部分则称之为环境.热化学方程式中的H实际上是热力学中的一个物理量,叫做焓,在化学上表示一个封闭体系中化学体系的内能和对环境所作的功的和.一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态).
(1)化学反应中的ΔH是以________能的形式体现的.
对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为________0(填“大于”、“小于”),该反应是________(填“放热”、“吸热”)反应;
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关.所谓键能就是:在101.3 kPa、298 K时,断开1 mol气态AB为气态A、气态B时过程的焓变,用ΔH(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g) ΔH=436 kJ·mol-1],形成化学键时ΔH<0[如2H(g)=H2(g) ΔH=-436 kJ·mol-1].
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185 kJ·mol-1
ΔH(H2)=436 kJ·mol-1,ΔH(Cl2)=247 kJ·mol-1
则ΔH(HCl)=________.
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关.这就是有名的“Hess定律”.
已知:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1
2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1
3 Fe2O3(s)+CO(g)![]() 2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1
2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1
Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g) ΔH=19 kJ·mol-1
3FeO(s)+CO2(g) ΔH=19 kJ·mol-1
请写出CO还原FeO的热化学方程式:________.
如下图所示,在容器A中装有20℃的水50 mL,容器B中装有1 mol/L的盐酸50 mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2(g)  N2O4(g) ΔH=-57 kJ/mol,
N2O4(g) ΔH=-57 kJ/mol,
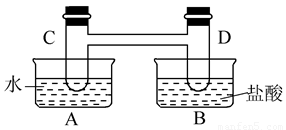
当向A中加入50 gNH4NO3晶体使之溶解;向B中加入2 g苛性钠时:
C中的气体颜色__________,D中的气体颜色__________(填“变浅”或“变深”)。
请简述原因 。
(2)若25℃时,起始时仅有NO2气体,反应2NO2 N2O4达到平衡时,c(NO2)=0.0125 mol/L,c(N2O4)=0.0321 mol/L,则NO2的起始浓度为__________,NO2的转化率为__________。
N2O4达到平衡时,c(NO2)=0.0125 mol/L,c(N2O4)=0.0321 mol/L,则NO2的起始浓度为__________,NO2的转化率为__________。
下列关于反应能量的说法正确的是( )
| A.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1, 则反应物总能量>生成物总能量 |
| B.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 |
| C.25 ℃、101 kPa时,2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1, 则H2的燃烧热为571.6 kJ·mol-1 |
| D.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com