
题目列表(包括答案和解析)
(15分)写出下列反应的热化学方程式:
(1)已知0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,写出能表示该反应燃烧热的热化学方程式
(2)NA表示阿伏加德罗常数,在CH4(g)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出445kJ的热量。____________________________________________
(3)已知拆开1molN≡N键,1molH-H键,1molN-H键分别需要的能量是a kJ、b kJ、
c kJ,则N2与H2反应生成NH3的热化学方程式为__________________________________
(4)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。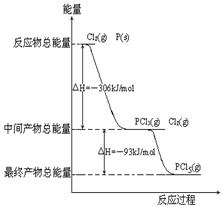
①P和Cl2反应生成PCl3的热化学方程式
②PCl5分解成PCl3和Cl2的热化学方程式_______________________
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施。化学反应的焓变一般通过实验进行测定,也可进行理论推算。
(1)实验测得,0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量。写出上述燃烧反应的热化学方程式 。标准状况下11.2L乙硼烷完全燃烧生成液态水时放出的热量是 kJ。
(2)在化学反应过程中,拆开化学键需要吸收能量,形成化学键又会释放能量。已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗496kJ能量,形成水蒸气中的1mol H-O键能够释放463kJ能量。试说明反应2H2(g)+O2(g)=2H2O(g)中的能量变化。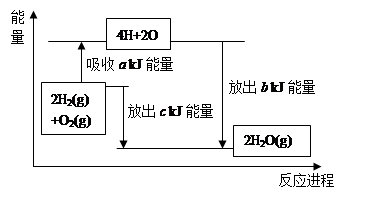
a= ,b= 。又知1mol液态水转化成气态水吸收44 kJ能量,则氢气完全燃烧生成液态水时的热化学方程式为 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。实验中不能直接测出由石墨和氢气生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧热分别如下:
①CH4(g)+2O2(g)=CO2(g)+2H2O ΔH1=-890.3 kJ?mol-1
②C(石墨)+O2(g)= CO2(g) ΔH2= —393.5 kJ?mol-1
③H2(g)+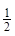 O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1
O2(g)=H2O(l) ΔH3= ─285.8 kJ?mol-1
④C(石墨)+2H2(g)= CH4(g) ΔH4
试根据盖斯定律求出石墨生成甲烷的反应热ΔH4= 。
已知0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放
出649.5KJ的热量。
(1)写出反应的热化学方程式
(2)已知H2O(l)转化为H2O(g)的△H=44KJ/mol,计算11.2L(标准状况)气态乙硼烷完全燃烧生成气态水时放出的热量为 。
已知0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放
出649.5KJ的热量。
(1)写出反应的热化学方程式
(2)已知H2O(l)转化为H2O(g)的△H=44KJ/mol,计算11.2L(标准状况)气态乙硼烷完全燃烧生成气态水时放出的热量为 。
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应的措施。化学反应的焓变一般通过实验进行测定,也可进行理论推算。
(1)实验测得,0.3mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量。写出上述燃烧反应的热化学方程式 。标准状况下11.2L乙硼烷完全燃烧生成液态水时放出的热量是 kJ。
(2)在化学反应过程中,拆开化学键需要吸收能量,形成化学键又会释放能量。已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗496kJ能量,形成水蒸气中的1mol H-O键能够释放463kJ能量。试说明反应2H2(g)+O2(g)=2H2O(g)中的能量变化。

a= ,b= 。又知1mol液态水转化成气态水吸收44 kJ能量,则氢气完全燃烧生成液态水时的热化学方程式为 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。实验中不能直接测出由石墨和氢气生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧热分别如下:
①CH4(g)+2O2(g)=CO2(g)+2H2O ΔH1=-890.3 kJ?mol-1
②C(石墨)+O2(g)= CO2(g) ΔH2= —393.5 kJ?mol-1
③H2(g)+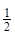 O2(g)=H2O(l)
ΔH3= ─285.8 kJ?mol-1
O2(g)=H2O(l)
ΔH3= ─285.8 kJ?mol-1
④C(石墨)+2H2(g)= CH4(g) ΔH4
试根据盖斯定律求出石墨生成甲烷的反应热ΔH4= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com