

题目列表(包括答案和解析)
(12分)通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌,不适于电器及其他许多工业使用,必须进行电解精炼。
⑴在精炼铜时,阳极减小的质量与阴极增加的质量是否相等 ▲ (填“是”或“否”);阳极下面沉积金属的成分主要是 ▲ 。
⑵在精炼铜的过程中,Cu2+浓度逐渐下降,c(Fe2+)、c(Zn2+)会逐渐 ▲ ,所以需要定时除去其中的Fe2+、Zn2+。甲同学设计了下列除杂方案I(见下图)。
请参照下表给出的数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | Zn(OH)2 |
| 开始沉淀时的pH | 7.6 | 5.2 | 2.7 | 8.0 |
| 完全沉淀时的pH | 9.6 | 6.7 | 3.7 | 11.0 |
①试剂a是 ▲ ,其目的是 ▲ 。
②操作①调节pH至b,b的取值范围是 ▲ 。
③调节溶液A的PH时可选择下列哪些试剂 ▲ 。
A.NaOH B.CuO C.Cu(OH)2 D.NH3·H2O E.Cu2(OH)2CO3
④操作②是 ▲ ,方案I中不能够除去的杂质金属阳离子是 ▲ 。
⑶乙同学在查阅课本时发现,“工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7-8,可使Fe3+生成Fe(OH)3沉淀而除去。”乙同学认为甲同学的方案I中也应该将溶液pH调至7-8。
你认为乙同学的建议是否正确? ▲ (填“是”或“否”)理由是 ▲ 。
(12分)通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌,不适于电器及其他许多工业使用,必须进行电解精炼。
⑴在精炼铜时,阳极减小的质量与阴极增加的质量是否相等 ▲ (填“是”或“否”);阳极下面沉积金属的成分主要是 ▲ 。
⑵在精炼铜的过程中,Cu2+浓度逐渐下降,c(Fe2+)、c(Zn2+)会逐渐 ▲ ,所以需要定时除去其中的Fe2+、Zn2+。甲同学设计了下列除杂方案I(见下图)。
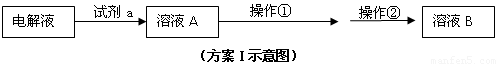
请参照下表给出的数据,回答下列问题:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
|
开始沉淀时的pH |
7.6 |
5.2 |
2.7 |
8.0 |
|
完全沉淀时的pH |
9.6 |
6.7 |
3.7 |
11.0 |
①试剂a是 ▲ ,其目的是 ▲ 。
②操作①调节pH至b,b的取值范围是 ▲ 。
③调节溶液A的PH时可选择下列哪些试剂 ▲ 。
A.NaOH B.CuO C.Cu(OH)2 D.NH3·H2O E.Cu2(OH)2CO3
④操作②是 ▲ ,方案I中不能够除去的杂质金属阳离子是 ▲ 。
⑶乙同学在查阅课本时发现,“工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7-8,可使Fe3+生成Fe(OH)3沉淀而除去。”乙同学认为甲同学的方案I中也应该将溶液pH调至7-8。
你认为乙同学的建议是否正确? ▲ (填“是”或“否”)理由是 ▲ 。

| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | Zn(OH)2 |
| 开始沉淀时的pH | 7.6 | 5.2 | 2.7 | 8.0 |
| 完全沉淀时的pH | 9.6 | 6.7 | 3.7 | 11.0 |

| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | Zn(OH)2 |
| 开始沉淀时的pH | 7.6 | 5.2 | 2.7 | 8.0 |
| 完全沉淀时的pH | 9.6 | 6.7 | 3.7 | 11.0 |
| ||

| pH | C(CrO42-)mol/L | C(HCrO4-)mol/L | C(Cr2O72-)mol/L | C(H2CrO4)mol/L |
| 4 | 0.0003 | 0.104 | 0.448 | 0 |
| 5 | 0.0033 | 0.103 | 0.447 | 0 |
| 6 | 0.0319 | 0.0999 | 0.437 | 0 |
| 7 | 0.2745 | 0.086 | 0.3195 | 0 |
| 8 | 0.902 | 0.0282 | 0.0347 | 0 |
| 9 | 0.996 | 0.0031 | 0.0004 | 0 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com