
题目列表(包括答案和解析)
| A.pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>① |
| B.10mL0.1mol/LCH3COOH溶液与20mL0.1mol/LNaOH溶液混合后,溶液中离子浓度关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
| C.aL0.1mol/LCH3COOH溶液与b L 0.1 mol/L NaOH溶液混合,若a<b,则不一定存在:n(OH-)-n(H+)>0.1(b-a) |
| D.浓度均为0.1mol?L-1的NaHCO3和Na2CO3混合液:c(Na+)>c(CO32-)>c(HLCO3-)>c(OH-)>c(H+) |
 常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水常温下,浓度均为0.1 mol/L的四种溶液:
①Na2CO3溶液 NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 ;
(2)比较①、②溶液,PH值较大的是 ;
(3)在溶液④中加入少量NH4Cl固体,此时![]() 的值将 (填“变小”,“变大”或“不变”);
的值将 (填“变小”,“变大”或“不变”);
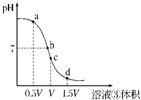
(4)用溶液③滴定V mL溶液④,其滴定曲线如右图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点:
水的电离程度最大的是 点,理由是;
;
②a点溶液中离子浓度大小关系是 ;
③取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,离子浓度大小关系是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com