
题目列表(包括答案和解析)
(8分)化学反应的快慢和限度对人类生产生活有重要的意义。
(1)请将影响表中“实例”反应速率的“条件”仿照示例填在空格横线上。
| 实例 | 影响条件 |
| ①食物放在冰箱里能延长保质期 | 温度(示例) |
| ②实验室将块状药品研细,再进行反应 | ____________ |
| ③用H2O2分解制O2时,加入MnO2 | ____________ |
| ④工业制硫酸催化氧化SO2制取SO3时,通入过量的空气 | ____________ |

 2C(g)+D(g) △H=xkJ/mol。恒温条件下,在一体积为2L的密闭容器中充入一定量A和B进行该反应,测得4s时反应放热225.6 kJ,并测得不同时间B的物质的量如下表所示
2C(g)+D(g) △H=xkJ/mol。恒温条件下,在一体积为2L的密闭容器中充入一定量A和B进行该反应,测得4s时反应放热225.6 kJ,并测得不同时间B的物质的量如下表所示

 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.药品:Cu、Fe、Na和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L);装置如图.
影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.药品:Cu、Fe、Na和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L);装置如图.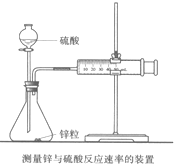 影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中 ② 分别投入大小、形状相同的铜、铁、镁 分别投入大小、形状相同的铜、铁、镁 |
反应速率镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com