
题目列表(包括答案和解析)
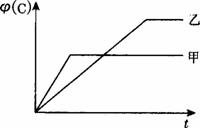
A.研究压强对化学反应速率的影响时,甲的压强较大
B.研究压强对化学平衡的影响时,x>3
C.研究温度对化学反应速率的影响时,乙的温度较高
D.研究温度对化学平衡的影响时,a<0
下列关于压强对化学反应速率的影响的说法中正确的是
[ ]
A.对于任何化学反应,增大压强都可加快它们的反应速率
B.对于气体反应,增大压强相当于增加反应物浓度,所以反应速率加快
C.对于固态或非固态反应物,由于压强对它们的体积改变很小,可以认为压强与它们的反应速率无关
D.增大压强可以加快合成氨的反应速率
下列关于压强对化学反应速率的影响的说法中正确的是
[ ]
A.对于任何化学反应,增大压强都可加快它们的反应速率
B.对于气体反应,增大压强相当于增加反应物浓度,所以反应速率加快
C.对于固态或非固态反应物,由于压强对它们的体积改变很小,可以认为压强与它们的反应速率无关
D.增大压强可以加快合成氨的反应速率
 CO(g)+3H2(g)△H=+206.1kJ?mol-1.
CO(g)+3H2(g)△H=+206.1kJ?mol-1.| CH4 | H2O | CO | H2 |
| 3.0mol?L-1 | 8.5mol?L-1 | 2.0mol?L-1 | 2.0mol?L-1 |
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol?L-1 | H2O初始浓度/mol?L-1 | K |
| 1 | 360 | P | 2.00 | 6.80 | K1 |
| 2 | t | 101 | 2.00 | 6.80 | K2 |
| 3 | 360 | 101 | 2.00 | 6.80 | K3 |
| ||
| x |
| 2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com