
题目列表(包括答案和解析)
⑴常温下取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+)________0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合物中下列算式的精确计算结果(填具体数字):c(Cl-)—c(M+)=________mol/L,c(H+)—c(MOH)=________mol/L.
⑵如果常温下取0.2mol/LMOH溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的PH<7,则说明MOH的电离程度________MCl的水解程度.(填“>”、“<”、或“=”)
(3)弱酸的相对强弱可以用电离常数(K)表示.以HF为例,其电离常数的计算方法是:K=![]() [c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度].同样,弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样.资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11.回答下列问题:常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数(忽略第二步水解)Kh=________,c(OH-)=________.
[c(H+)、c(F-)、c(HF)为HF在水溶液中达电离平衡时的浓度].同样,弱酸盐和弱碱盐的水解程度也可用水解常数(Kh)表示,其计算方法和电离常数一样.资料表明,H2CO3在水中分两步电离,常温时的电离常数分别为K1=4.3×10-7,K2=4.8×10-11.回答下列问题:常温时0.1mol/L的Na2CO3溶液中CO32-的水解常数(忽略第二步水解)Kh=________,c(OH-)=________.
(16分)运用相关原理,回答下列各小 题:
题:
Ⅰ.已知NaHSO4在水中的电离方程式为NaHSO4=Na++ H++ SO4 2-。
2-。
(1)在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填“>”、“=”或“< ”
” 下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH 7。
(2)将 20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
0.001 mol·L-1BaCl2溶液,首先析出的沉淀是 。[KSP(BaSO4)=1.1×10-10mol2·L-2;KSP(BaCO3)=5.1×10-9mol2·L-2]
Ⅱ.已知:在25时 H2O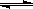 H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH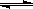
 H++CH3COO--> Ka=1.8×10-5
H++CH3COO--> Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 。当升高温度时,Kh将 (填“增大”“减小”“不变”);
(4)0.5mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)
 为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
为a;1mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 (填“大于”“小于”“等于”);
(5)0.9mol·L-1醋酸钠溶液中[OH-]= mol·L-1
在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol·L-1。向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,以上三种金属离子中 能生成沉淀,原因是 。
(KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、
KSP[Cd(OH)2]=2.5×10-14、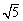 =2.2)
=2.2)
 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH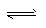 H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5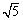 =2.2)
=2.2) 【化学——选修化学与技术】(15分)现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下: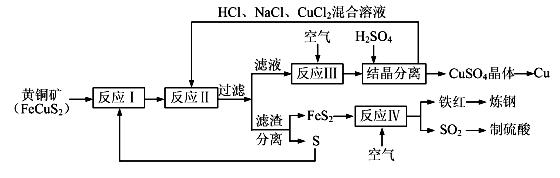
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是 _____________________ ________、___________________________________ 。
(2)反应Ⅰ的产物为(填化学式) ___________________ 。
(3)反应Ⅲ的离子方程式为 ____________________________________________________ 。
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是 ___________
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2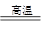 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
| A.反应中被还原的元素只有氧 | B.反应生成的SO2直接排放会污染环境 |
| C.SO2既是氧化产物又是还原产物 | D.当有8mol铜生成时,转移电子数目为100NA |
【化学——选修化学与技术】(15分)现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:

注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是 _____________________ ________、___________________________________ 。
(2)反应Ⅰ的产物为(填化学式) ___________________ 。
(3)反应Ⅲ的离子方程式为 ____________________________________________________ 。
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是 ___________
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
A.反应中被还原的元素只有氧 B.反应生成的SO2直接排放会污染环境
C.SO2既是氧化产物又是还原产物 D.当有8mol铜生成时,转移电子数目为100NA
(6)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2O72-+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ____________________________________ 。
②反应Ⅳ所得气体中SO2的体积分数为________________________________________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com