
题目列表(包括答案和解析)
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5的酸碱性为________,试样的PH值________
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:
H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 KJ/molC(s)+1/2O2(g)=CO(g) ΔH=-110.5 KJ/mol
写出焦炭与水蒸气反应的热化学方程式________;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是________.
a.Ca(OH)2
b.Na2CO3
c.CaCl2
d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:
N2(g)+O2(g)![]() 2NO(g) ΔH>0
2NO(g) ΔH>0
若1 mol空气含有0.8 mol N2和0.2 mol O2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4 mol.计算该温度下的平衡常数K=________.
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是________.
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g)已知该反应的ΔH>0,简述该设想能否实现的依据________.
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为________.
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4x10-6 | 6x10-6 | 2x10-5 | 4x10-5 | 3x10-5 | 2x10-5 |
根据表中数据判断PM2.5的酸碱性为——,试样的PH值=————
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g) ![]() H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g)
H= -241.8KJ/mol C(s)+1/2O2(g)=CO(g) ![]() H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式——————————————————;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是————
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:
N2(g)+O2(g) ![]() 2NO(g)
2NO(g) ![]() H>0
H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8x10-4mol.计算该温度下的平衡常数K= ___________
汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是——————————
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的![]() H>0,简述该设想能否实现的依据————————
H>0,简述该设想能否实现的依据————————
③目前,在汽车尾气系统中装置催化转化器可减少 CO和NO的污染,其化学反应方程式为———————————
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 1 |
| 2 |
| 1 |
| 2 |
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
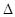 H= -241.8KJ/mol
H= -241.8KJ/mol 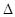 H= -110.5KJ/mol
H= -110.5KJ/mol 2NO(g)
2NO(g) 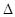 H>0
H>0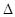 H>0,简述该设想能否实现的依据 。
H>0,简述该设想能否实现的依据 。某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
|
离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
|
浓度/mol.L |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH值 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g)
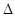 H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g) 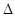 H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g) 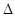 H>0
H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的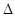 H>0,简述该设想能否实现的依据 。
H>0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com