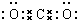下图为一些物质之间的转化关系,其中部分反应中反应物或生成物未列全.已知A、H、I、K均为家庭厨房中的常见物质,其中A是食品调味剂,H是消毒剂的有效成分,I、K可用作食品发泡剂.B是一种有机酸盐,E、F、(二者物质的量之比为1:1)和G均为氧化物,L是红褐色沉淀.
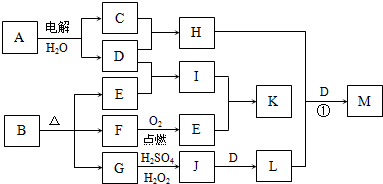
根据以上信息,回答下列问题:
(1)E的电子式
.
(2)用碳棒作阳极,铁作阴极,电解滴有酚酞的A的饱和溶液.接通电源一段时间后,阴极附近溶液红色,其变红的原因是
H+在阴极不断得到电子成为H2,从而破坏了水的电离平衡,使c(OH-)>c(H+)
H+在阴极不断得到电子成为H2,从而破坏了水的电离平衡,使c(OH-)>c(H+)
.
(3)G→J的离子方程式为
2FeO+H2O2+6H+=2Fe3++4H2O
2FeO+H2O2+6H+=2Fe3++4H2O
.
(4)反应①中H能将L氧化,生成一种含氧酸盐M(其中某元素的化合价为+6)和其它两种物质,且H、L、D的物质的量之比为3:2:4,则H+L+D→M的化学方程式为
3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O
3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O
.
(5)鉴别等物质的量浓度的I、K稀溶液的实验方法为
取I、K的稀溶液,分别滴加CaCl2溶液,出现白色沉淀者为I
取I、K的稀溶液,分别滴加CaCl2溶液,出现白色沉淀者为I
.