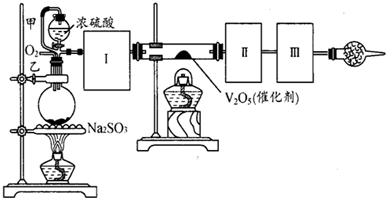
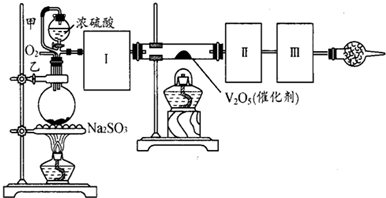
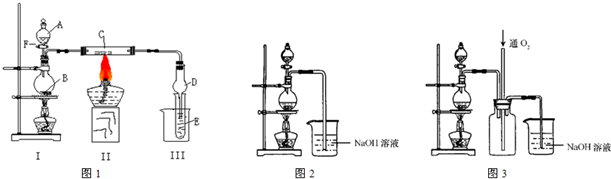
(I)按照如图1所示装置进行有关实验,拔掉分液漏斗玻璃塞,将A逐滴加入B中.
若A是浓盐酸,B为二氧化锰,当将A滴入B中时发生反应的离子方程式为:
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O
;
当实验一段时间后,发现C、D中有红棕色烟,则C的化学式为:
Fe
Fe
.
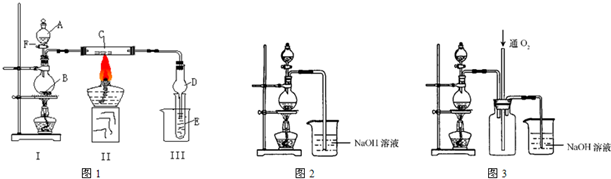
(II)硫酸铜是一种应用极其广泛的化工原料,可通过多种途径制取硫酸铜晶体.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图2所示).
请回答相关问题:
(1)图2分液漏斗中装的液体是
浓硝酸
浓硝酸
;
(2)本实验中若硝酸过量,造成的结果是
制得的硫酸铜晶体不纯
制得的硫酸铜晶体不纯
;
(3)图3是图2的改进装置,其优点是①
有利于氮氧化合物的吸收
有利于氮氧化合物的吸收
,②
防止倒吸
防止倒吸
;
(4)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:将铜粉在某仪器中反复灼烧,使铜粉与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向混合物中加入Fe
2(SO4)
3,即发生反应.反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)
3沉淀,过滤、蒸发、结晶,得硫酸铜晶体,滤渣循环使用〔已知Fe(OH)
3和Cu(OH)
2完全沉淀时的pH分别为3.7、6.4〕.
①方案1中用于灼烧铜粉的仪器名称是
坩埚
坩埚
;
②方案2中甲物质可以是
ab
ab
(填字母序号);
a.CuO b.CuCO
3 c.CaCO
3 d.NaOH
③方案2中发生反应的总化学方程式为(注明反应条件)
.