
题目列表(包括答案和解析)
某课外学习小组的同学设计了如图的装置,以验证SO2的氧化性、还原性和漂白性。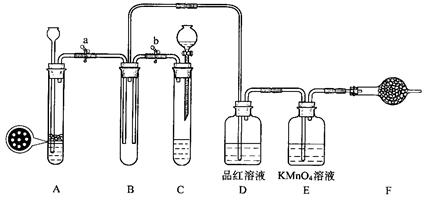
回答以下问题:
33.单独检查装置C的气密性的操作是,关闭活塞b,然后________________________,
若发现________________,说明装置C气密性良好。
34.用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
35.小组的同学在A、C装置中的另一个用FeS固体和稀硫酸制取H2S气体,反应的化学方程式为_________________ 。
36.SO2气体通过D装置时现象是____________________ ,通过E装置时现象是
________________ ;SO2与H2S在B装置中反应,现象是______________________。
37.F中盛有碱石灰,其作用是______________________。



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com