
题目列表(包括答案和解析)
已知t℃时,盐M(不含结晶水,式量=126)的溶解度为S g.在一定量的M的水溶液中加入a g M后,恰好为t℃时的饱和溶液.若用M·7H2O代替M,欲使原溶液在t℃时恰好饱和,则需加入M·7H2O的质量为
[ ]
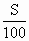 )a g
)a g g
g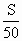 )a g
)a gA.2a B.![]()
C.(2+![]() )a D.(1+
)a D.(1+![]() )a
)a
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com