
题目列表(包括答案和解析)
某种纯净水生产线的主要工艺流程如图:

阅读该纯净水生产线的有关资料后回答问题:
资料:反渗透器的核心部件是RO芯,RO芯是由多层反渗透复合膜组成的,原用于太空宇航员进行废水再生。RO芯的孔径很小,大约是普通细菌的1/600,细小固体,有机物杂质不能透过,简单离子、水可以通过。生产时为保证成品的质量,通常控制水压使成品产率在50%左右。
RO芯部分工作参数如下:
|
硬度 |
铁 |
游离氯 |
有机物 |
… |
|
<1.7 mg·L-1 |
<0.1 mg·L-1 |
0.1 mg·L-1 |
<1 mg·L-1 |
… |
(1)纯净水一定是不含任何杂质的水吗?
(2)许多食品、饮料都以大肠杆菌的含量作为卫生标准之一,主要原因是什么?
(3)水中的Ca2+和Mg2+是引起水的硬度的主要因素,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其质量折算成Ca2+的质量,以1 L水中含有的CaO的质量来表示。可用一定浓度的Y溶液进行滴定,Y跟Ca2+和Mg2+都以等物质的量完全反应。该工厂现用地下水生产纯净水,取地下水样品25.0 mL,用0.0100 mol·L-1 Y溶液滴定,完全反应时消耗Y溶液15.0 mL。试判断该地下水是否可直接用来生产纯净水?
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g) ΔH < 0。
CH3OH(g) ΔH < 0。
原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
| CO2%-CO%- H2% (体积分数) | 03070 | 22870 | 42670 | 82270 | 201070 | |||||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | |
| 碳转 化率 (%) | CH3OH | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 | 8.0 | 12.0 | 22.6 |
| CH4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2.8 | 2.8 | 2.8 | |
(1)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:___________________________________________________________
____________________________________________________________________。
为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验。
| 组别 | 体积分数(%) | |||
| CO | CO2 | H2 | N2 | |
| 第1组 | 19.7 | 0.0 | 59.1 | 21.2 |
| 第2组 | 20.7 | 0.3 | 62.1 | 16.9 |
| 第3组 | 16.9 | 1.3 | 50.7 | 31.1 |
| 第4组 | 19.8 | 5.5 | 59.4 | 15.3 |
| 第5组 | 20.3 | 10.9 | 60.9 | 7.9 |
进行该验证实验时,控制不变的因素有________________、_________________、__________
__________________________________等。
某活动小组利用如图装置验证N0的还原性及探究工业生产硝酸的原理。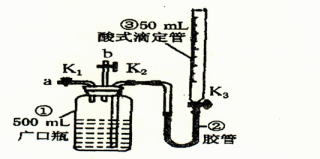
如何检查该装置气密性 。
(一)向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加入水,让水充满广口瓶①,且调节滴定管③中液面与①相平并记录滴定管③的刻度。
(2)从导管a通入一定量的NO并准确测定通入NO的体积的主要操作: ;计算出通入的NO的体积为V mL(V<50)。
(二)验证NO的还原性;探究工业生产硝酸的原理
(1)停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,写出通入O2的过程中发生的化学反应方程式: 。
(2)继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直到广口瓶①中刚好充满液体。
I.当通入氧气的体积为V/2mL时,则广口瓶①的气体体积为 ;
II.当广口瓶①的气体体积为V/2 mL时,则通入氧气的体积可能为 。
哈伯因发明了氮气和氢气合成氨气的方法而获得1918年的诺贝尔化学奖,
N2(g)+3H2(g)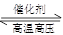 2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度: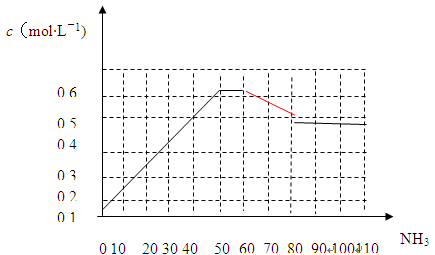
(1)此反应在50~60s时化学平衡常数为K1 = (列出计算式不用试算)。
(2)反应进行到60s时,改变的条件可能是 。
| A.加入催化剂 | B.扩大容器的体积 |
| C.升高温度 | D.减小氨气的浓度 |
2013年雾霾天气多次肆虐我国中东部地区。其中汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作KP),则该反应的KP=-???????????????? 。
②该反应在低温下能自发进行,该反应的ΔH ????????? 0。(选填“>”、“<”)
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2 --tl=t3-t2)。

则下列说法不正确的是????????? 。(填编号)
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:tl~t2>t2~t3
(2)煤的综合利用、使用清洁能源等有利于减少环境污染。合成氨工业原料气的来源之一水煤气法,在催化剂存在条件下有下列反应:
①
②
③
①△H3和△H1、△H2的关系为△H3=???????????? 。
②在恒温条件下,将l mol CO和1 mol H2O(g)充入某固定容积的反应容器,达到平衡时有50%的CO转化为CO2。在tl时保持温度不变,再充入1 mol H2O(g),请在图中画出tl时刻后H2的体积分数变化趋势曲线。

③甲醇汽油可’以减少汽车尾气对环境的污染。
某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)  CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正)??????? ? v(逆)(选填‘‘>”、“<’’或“=”),判断的理由??????? 。
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正)??????? ? v(逆)(选填‘‘>”、“<’’或“=”),判断的理由??????? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com