
题目列表(包括答案和解析)
已知一种c(H+)=1×10-3 mol/L的酸和一种c(OH-)=1×10-3 mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是 ( )
A. 浓的强酸和稀的强碱溶液反应
B. 浓的弱酸溶液和稀的强碱溶液反应
C. 等浓度的强酸和弱碱溶液反应
D. 生成了一种强酸弱碱盐
Ⅰ.已知在常温常压下:
① 2CH3OH(l)十3O2(g)=2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
② H2O(l)=H2O(g) △H="+" 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式 。
Ⅱ.磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:

(1)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程式为 。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是 。(填选项字母)
A、C(Na+)> C(H2PO4 -)> C(H+)> C(HPO4 2-)> C(H3PO4 )
B、C(Na+)> C(H2PO4 -)> C(OH-)> C( H3PO4)> C(HPO4 2- )
C、C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )
D、C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )
(3)假设25℃条件下测得0.1 mol·L–1的Na3PO4溶液的pH=12 ,近似计算出Na3PO4的第一步水解的水解常数Kh(写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字)。
Ⅲ.化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染。电化学降解NO3-的原理如图所示。电源正极为 (填A或B),阴极反应式为 。
电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
编号 物质(微粒) 电离度α
A 硫酸溶液(第一步完全电离): 第二步 HSO4- H++SO42- 10%
H++SO42- 10%
B 硫酸氢钠溶液: HSO4- H++SO42 29%
H++SO42 29%
C 醋酸: CH3COOH CH3COO-+H+ 1.33%
CH3COO-+H+ 1.33%
D 盐酸: HCl=H++Cl- 100%
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是 (填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1 mol·L-1硫酸氢钠
溶液中HSO4-的电离度,其原因是 。
(3)醋酸的电离平衡常数K的表达式是 ,醋酸的电离平衡常数
K与电离度α的关系式为:K= (用含α的代数式表示)
电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离): 第二步 HSO4- H++SO42- H++SO42- | 10% |
| B | 硫酸氢钠溶液: HSO4- H++SO42 H++SO42 | 29% |
| C | 醋酸: CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.33% |
| D | 盐酸: HCl=H++Cl- | 100% |
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)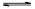 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com