
题目列表(包括答案和解析)
A. A、B、C、D、E、F为原子序数依次增大的短周期主族元素。 A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F。
⑴写出B的基态原子的核外电子排布式 。
⑵A、C形成的最简单分子极易溶于水,其主要原因是 ;与该最简单分子互为等电子体的阳离子为 。
⑶比较E、F的第一电离能:E F(选填“>”或“<”)。
⑷BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为 。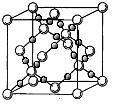
⑸光谱证实单质F与强碱性溶液反应有[F(OH)4]—生成,则[F(OH)4]—中存在 。
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
B.某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
⑴提出假设 ①该反应的气体产物是CO2。
②该反应的气体产物是CO。
③该反应的气体产物是 。
⑵设计方案 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
⑶查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式: 。
⑷实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
⑸数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:
。
⑹实验优化 学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 。
②从环境保护的角度,请你再提出一个优化方案: 。
元素在元素周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是
( )
A.同一元素不可能既表现金属性,又表现非金属性
B.短周期元素形成离子后,最外层都达到8 电子稳定结构
C.第三周期元素的最高正化合价等于它所处的主族序数
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
元素在周期表中的位置,反映了元素的原子结构和性质,下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com