
题目列表(包括答案和解析)
 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知CH3OH(l)O2(g)=CO(g)+2H2O(g) △Ha=-443.64KJ?mol-1 2CO(g)+O2(g)=2CO2(g)
甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料。已知CH3OH(l)O2(g)=CO(g)+2H2O(g) △Ha=-443.64KJ?mol-1 2CO(g)+O2(g)=2CO2(g)
△Hb=-566.0KJ?mol-1
(1)试写出CH3OH(l)在氧气中完全燃烧生成CO2和H2O(汽)的热化学方程式: ____________________________________________________________________________________________________________
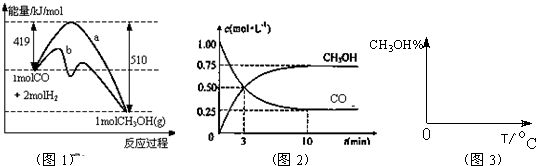
(2)有人认为:在一定条件下,完全可实现由CO2和H2O(汽)来制取CH3OH(l)的反应,从而能缓解能源紧张和温室效应的问题。试通过计算说明,这种反应是否具有可行性?
(3)科研人员新近开发出一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,据此回答下列问题:
甲醇在__________极反应;电极反应式为____________________________________________
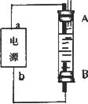
(4)利用电池可实现电能向化学能转化。某同学设计了一种电解法制取Fe(OH)2的实验装置,通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是_____(填序号)
A. 电源中的a一定为正极,b一定为负极
B. 可以用NaCl作为电解液
C. A、B两端都必须用铁作电极
D. 阴极发生的反应是:2H++2e-→H2↑
| |||||||||||||||||||||||||
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
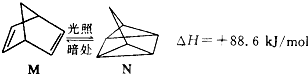
| 1 |
| 2 |
| 共价键 | H-N | H-O | N≡N | O=O |
| 断裂1mol化学键所需能量/kJ/mol | 393 | 460 | 941 | 499 |
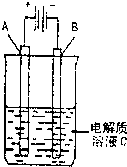 (2011?太原二模)现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因.
(2011?太原二模)现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com