
题目列表(包括答案和解析)
|
有一瓶Na2SO3溶液,可能部分被氧化.某同学用此溶液进行如下实验:取少量溶液,滴入硝酸钡溶液产生白色沉淀,再加入足量稀HNO3,充分振荡后仍有白色沉淀,对此实验下列结论正确的是 | |
| [ ] | |
A. |
Na2SO3已部分氧化 |
B. |
加入硝酸钡溶液生成的沉淀一定含BaSO4 |
C. |
加入HNO3后的不溶沉淀一定为BaSO3 |
D. |
此实验不能确定Na2SO3是否部分氧化 |

| 实验步骤 | 预期现象与结论 |
| 步骤1:用适量白色沉淀于试管中,加入少量蒸馏水,滴加几滴品红溶液 | 白色沉淀不溶解,溶液呈红色. |
| 步骤2:往上述试管中滴加足量 稀盐酸 稀盐酸 ,充分振荡. |
若 沉淀部分溶解 沉淀部分溶解 ,则含有②. |
| 217m |
| 64w |
| 217m |
| 64w |
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。2分
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。2分
③ 某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,有利于提高SO2的吸收效率。2分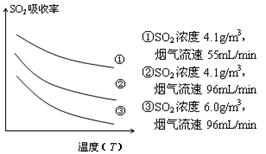
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式_________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是 (填字母)。



A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,
有利于提高SO2的吸收效率。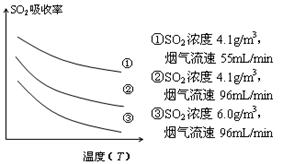
(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_ (填字母)。
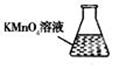

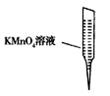
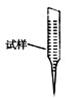
A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com