
题目列表(包括答案和解析)

 5Cl-+ClO3-+3H2O
5Cl-+ClO3-+3H2O
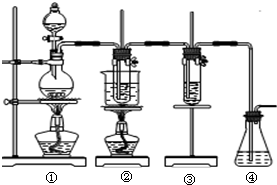 在实验室里可用右图所示装置制取氯酸钾和探究氯水的性质. 图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置.请填写下列空白:
在实验室里可用右图所示装置制取氯酸钾和探究氯水的性质. 图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置.请填写下列空白: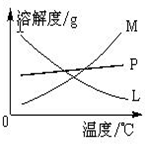 图中符合该晶体溶解度曲线的是
图中符合该晶体溶解度曲线的是| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红色 红色 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 氯气与水反应生成HClO具有漂白性 |
| 然后溶液从无色逐渐变为 浅黄绿色 浅黄绿色 色 |
过量氯气溶解于水中 过量氯气溶解于水中 |
(10分)在实验室里可用如图所示装置制取氯酸钾和探究氯水的性质。图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置。请填写下列空白: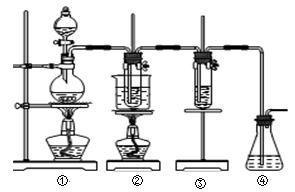
⑴制取氯气时,先在烧瓶里加入一定量的二氧化锰,再通过__________ ___(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_____________(填写下列编号字母)的净化装置。
___(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_____________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸
⑵如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因有:①_______________________________________________,
②__________________________________________________________________________。
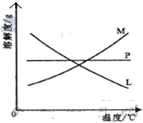
⑶反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
⑷实验中可观察到③的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为_______色 | ______________________________________ |
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为 黄绿 黄绿 色 |
继续通入的氯气溶于水使溶液呈黄绿色 继续通入的氯气溶于水使溶液呈黄绿色 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com