
题目列表(包括答案和解析)
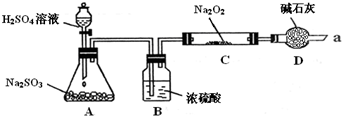

| 假设 | 实验验证方法及现象 | |
| 假设1 | 白色浑浊物是BaSO3. | (1) 在白色浑浊物中加入过量盐酸,会变澄清 在白色浑浊物中加入过量盐酸,会变澄清 |
假设2 |
(2)白色浑浊物是BaSO4,主要 原因是 Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4 Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4 . |
反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊.滴加FeCl3溶液后出现浑浊 (3)通入纯净的CO2的目的 防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 |
| O | 2- 3 |
| O | 2- 4 |


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com