
题目列表(包括答案和解析)
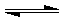
 I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,
I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中, 2X
2X 2X
2X 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
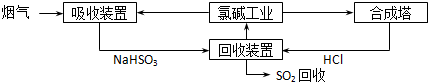
 2SO3 的两个素材:
2SO3 的两个素材:

| 分析推测 | 实验步骤 | ||
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2)
|
ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
 2SO3在不同条件下进行时SO2的转化率:
2SO3在不同条件下进行时SO2的转化率:| 温度\压强 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).


取5 mL 0.1 mol·L-1KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴,继续加入2 mLCCl4,充分振荡,静置。下列有关该实验的说法不正确的是( )
A.下层CCl4溶液呈紫红色
B.取少量上层溶液,滴加酸性AgNO3溶液,若有黄色沉淀产生,则表明该反应存在化学反应限度
C.取少量上层溶液,滴加KSCN溶液,若溶液显红色,则表明该反应存在化学反应限度
D.该实验中KI与FeCl3反应后(未加CCl4),溶液中存在Fe3+、Fe2+、I—、I2等微粒
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com