
题目列表(包括答案和解析)
化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.下图为N2(g)和O2(g)生成NO(g)过程中的能量变化
(■图片不清晰)
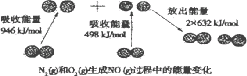
人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,则N![]() N的键能为________kJ/mol,由上图写出N2(g)和O2(g)生成NO(g)的热化学方程式________.
N的键能为________kJ/mol,由上图写出N2(g)和O2(g)生成NO(g)的热化学方程式________.
关于化学反应中的能量变化,下列说法中不正确的是( )
| A.燃烧反应都是放热反应 |
B.对于可逆反应:aA(g)+bB(g) bC(g)+dD(g),如果正反应放热,逆反应一定吸热 bC(g)+dD(g),如果正反应放热,逆反应一定吸热 |
| C.氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 |
| D.只有放热的氧化还原反应才可以设计为原电池 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)与 O2(g)反应生成NO(g)过程中的能量变化:
下列说法正确的是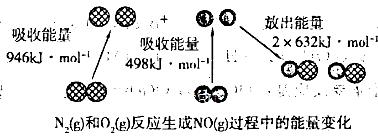
| A.1 mol N2(g)和1 molO2 (g)具有的总能量大于 2 mol NO(g)具有的总能量 |
| B.1 molN2 (g)和l molO2 (g)反应生成2 mol NO(g)吸收180 kJ热量. |
| C.通常情况下N2(g)和O2(g)混合能直接反应生成NO |
| D.数据不足,不能确定反应热的大小 |
在研究化学反应中的能量变化时我们通常做下面的实验:
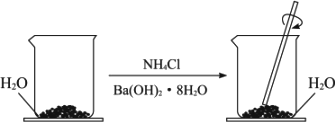
在一个小烧杯里加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3-4滴水的玻璃片(或三合板)上,然后向烧杯内加入约10 g NH4Cl晶体,并立即用玻璃棒迅速搅拌.
试完成下列问题:
(1)写出反应的化学方程式:________.
(2)实验中要立即用玻璃棒迅速搅拌的原因是________.
(3)如果实验中没看到“结冰”现象,可能的原因是________________.(答出三个或三个以上原因).
(4)如果没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?
________(答出两种方案).
(5)实验中即使不“结冰”,提起烧杯的时候,发现烧杯与玻璃片也“粘在一起了”,原因是______________________________________.
(6)试用简单的方法说明烧杯与玻璃片之间是因为“结冰”而粘在一起的:____________________________________________.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示.请认真观察下图,然后回答问题:
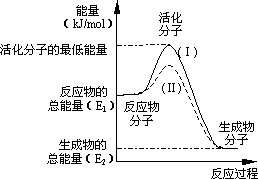
(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的ΔH=________(用含E1、E2的代数式表示).
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g);ΔH=-241.8 kJ/mol.该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为________.
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率明显加快,你认为最可能的原因是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com