化学电池在日常生活中有着广泛的应用.
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H
2O
2Ni(OH)
2+Cd(OH)
2已知Ni(OH)
2和Cd(OH)
2均难溶于水但能溶于酸,以下说法中正确的是
B
B
.
①以上电池反应是在非水溶液中进行的 ②以上电池反应是在强碱溶液中进行的
③以上电池反应不需要电解质就能进行 ④电池工作时是化学能转变为电能
A.①③B.②④C.①④D.②③
(2)另一种常用的电池是锂电池由于它的容量特别大而广泛应用于心脏起搏器,一般使用时间可长达十年.电池总反应可表示为:Li+MnO
2=LiMnO
2,它的负极材料是
锂
锂
,电极反应式为
Li-e-=Li+
Li-e-=Li+
;锂电池中的电解质溶液需用非水溶剂配制,其原因用化学方程式表示为
2Li+2H2O=2LiOH+H2↑
2Li+2H2O=2LiOH+H2↑
.
(3)铅蓄电池是典型的可充型电池,电池总反应式为:
Pb+PbO
2+4H
++2SO
2PbSO
4+2H
2O
放电时电解液中H
2SO
4的浓度将变
小
小
;当外电路通过1mol电子时,理论上负极板的质量增加
48
48
g.
(4)随着人们生活质量的不断提高,废弃的电池必须进行集中处理的问题被提到议事日程,其首要原因是
防止电池中的汞、镉和铅等重金属离子对土壤和水源的污染
防止电池中的汞、镉和铅等重金属离子对土壤和水源的污染
.

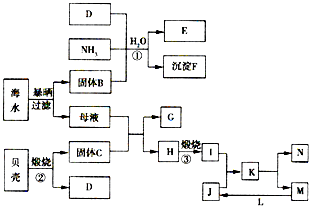 [化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).
[化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).