
题目列表(包括答案和解析)
Ⅰ.已知:温度过高时,WO2(s)转变为WO2(g):
![]()
![]()
则![]() 的?H=______________。
的?H=______________。
Ⅱ.1100℃时,在体积为2L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g).
(1)下列能判断该反应达到平衡状态的条件是 。
A、容器中压强不变 B、混合气体密度不变
C、1molH-H键断裂的同时形成2molH-O键 D、H2的体积分数不变
(2)若2min时反应达到平衡,此时气体质量增加了8g,则用H2表示该反应的化学反应速率为 。
(3)某温度下该反应达到平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为 。
(4)若降低温度,K值减小,则反应的△H (填“>”或“<”)0。
(5)若反应达平衡后,向体系中加入少量的H2,则反应再次达平衡后,H2?O(g)的体积分数 (填“增大”、“减小”或“不变”)。
Ⅲ、某500mL电解溶液中含0.1molNaCl和0.1molCuSO4。在恒定电流的情况下进行电解,2min后阴极开始产生气体,5min时停止电解,此时两极产生的气体体积理论上相同。
①写出此过程中阳极的电极反应式________________,
_____________________________。
②将溶液稀释为1000ml后,所得溶液的pH为 。
Ⅳ、在0.1 的CrCl3 溶液中加氢氧化钠溶液,有Cr(OH)3沉淀产生,常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH―)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
Ⅰ已知在常温常压下:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)?? △H=_1275.6kJ?mol-1
②H2O(l)═H2O(g)?? △H=+44.0kJ?mol-1写出表示甲醇燃烧热的热化学方程式:??????????????? 。
Ⅱ.甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g)  CO2(g) + 3H2(g) ;△H>0
CO2(g) + 3H2(g) ;△H>0
(1)一定条件下,向体积为2L的恒容密闭容器中充入1molCH3OH(g)和3molH2O(g),20s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为 ???? 。
(2)判断 ⑴ 中可逆反应达到平衡状态的依据是(填序号) ??????????? 。
①v正(CH3OH) = 3v逆(H2) ? ②混合气体的密度不变 ③混合气体的平均相对分子质量不变?????? ④CH3OH、H2O、CO2、H2的浓度都不再发生变化???? ⑤CO2和H2的浓度之比为1:3
(3)图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1molCH3OH(g)和2molH2O(g),向B容器中充入1.2molCH3OH(g) 和2.4molH2O(g),两容器分别发生上述反应。? 已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.5aL,容器B中CH3OH转化率为 ;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为 L(连通管中气体体积忽略不计,且不考虑温度的影响)。

Ⅲ.如图甲、乙是电化学实验装置。请回答下列问题:

(1)若两池中均盛放CuSO4溶液
①甲池中石墨棒上的电极反应式为____________________.
②如果起始时乙池盛有200mL CuSO4溶液,电解一段时间后溶液蓝色变浅,若要使溶液恢复到电解前的状态,需要向溶液中加入0.8g CuO,则其电解后的pH为????? (忽略溶液体积的变化)。
(2)若甲池中盛放饱和NaCl溶液,则甲池中石墨棒上的电极反应式为__________________.
(13分)碳及其化合物有广泛的用途。
(1)写出用碳棒作电极电解饱和食盐水的离子方程式: 。 (2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
(2)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g)
ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 (3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
(3)将一定量的CO(g)和H2O(g)分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。

现有如下两个反应:
Ⅰ. A.2NaOH+H2SO4==Na2SO4+2H2O B.CH4+2O2==CO2+2H2O
(1)根据反应的本质,两个反应都为 反应(放热或吸热),判断两个反应能否设计为原电池?(能或不能)A B
(2)如果不能,说明其理由
(3)如果能,最好应选择 电解质溶液(NaOH或H2SO4)。则负极电极反应式: 正极电极反应式:
Ⅱ. 电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,
同时在两边各滴入几滴酚酞试液,则电解池中X极上的
电极反应式为
在X极附近观察到的实验现象是
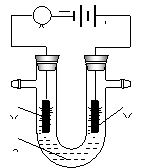 ②Y电极上的电极反应式为
②Y电极上的电极反应式为
|
③电解总反应化学方程式
(2)若X、Y都是惰性电极,a是CuSO4溶液,电解的总反应方程式 。
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
已知反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g) △H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4。
H2(g)+CO2(g) △H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4。

(1)850℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O(g),CO和H2O(g)浓度变化如右图所示,下列说法正确的是 (填序号)。
A.达到平衡时,反应体系最终会放出49.44kJ热量;
B.第4min时,混合气体的平均相对分子质量不再变化,可判断已达到平衡;
C.第6min时,若升高温度,反应平衡常数会增大; 850℃时物质浓度的变化
D.第8min时,若充入CO,会导致v(正)>v(逆),平衡向正反应方向移动。
(2)850℃时,若在容积为2L的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和x mol H2。若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
(3)如将H2与CO2以4∶1的体积比混合,在适当的条件下可制得CH4。已知:
CH4(g) + 2O2(g)=CO2 (g)+ 2H2O (1) ΔH1=-890.3 kJ/mol
H2(g)+![]() O2(g)=H2O (1) ΔH2=-285.8 kJ/mol
O2(g)=H2O (1) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。负极反应式为 ,正极反应式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com