2011年12月30日中国环境保护部通过了新修订的《环境空气质量标准》,调整了污染物项目及限值,增设了PM2.5平均浓度限值,收紧了二氧化氮等污染物的浓度限值.
(1)甲烷是一种清洁燃料,在一定条件下,发生反应:CH
4(g)+H
2O(g)?CO(g)+3H
2(g)△H>0.将1.0molCH
4和2.0molH
2O通入反应容器(假设容积为10L),10min末有0.10molCO生成,则10min内该反应的速率v(H
2)=
.
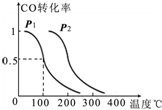
(2)某工厂利用尾气CO制甲醇,在一定压强和固定容积的容器中,通入a molCO与2a molH
2,在催化剂作用下反应:CO(g)+2H
2(g)?CH
3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
①P
1
P
2(填“<”、“>”或“=”).
②在其它条件不变的情况下,再增加a molCO与2a molH
2,达到新平衡时,CO的转化率
(填“增大”、“减小”或“不变”).
(3)某酒厂为减少CO
2的排放,用石灰水吸收CO
2,25℃达到沉淀溶解平衡时,测得溶液中c(CO
32-)=0.010mol?L
-1,求c(Ca
2+) (写出计算过程,已知:Ksp(CaCO
3)=2.8×10
-9).
(4)某硝酸厂处理尾气NO
2方法是:催化剂存在时用H
2将NO
2还原为N
2.
已知:2H
2(g)+O
2(g)═2H
2O(g)△H=-483.6 kJ/mol
N
2(g)+2O
2(g)═2NO
2(g)△H=+67.7 kJ/mol
则H
2还原NO
2生成水蒸气反应的热化学方程式是
.

