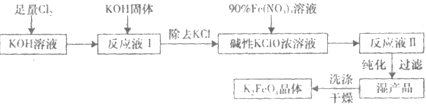
高铁酸钾(K
2FeO
4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.其生产流程如下:
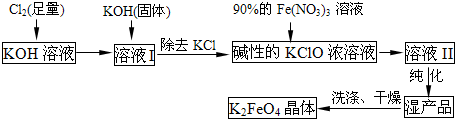
(1)KOH 与Cl
2反应放热,随着反应的进行,温度会逐渐升高,就会有KClO
3生成.所以,反应①应保持在
较低温度
较低温度
下进行.若测得溶液I中KClO和KClO
3的物质的量浓度之比为1:3,写出①反应的离子方程式
20OH
-+10Cl
23ClO
3-+ClO
-+16Cl
-+10H
2O
20OH
-+10Cl
23ClO
3-+ClO
-+16Cl
-+10H
2O
.
(2)在溶液I中加入KOH固体的目的是
bc
bc
(填编号).
a.KOH固体溶解时会放出较多的热量,有利于提高反应速率
b.与溶液I中过量的Cl
2继续反应,生成更多的KClO
c.为下一步反应提供碱性的环境
d.使KClO
3转化为 KClO
(3)从溶液II中分离出K
2FeO
4后,还得到副产品KNO
3、KCl,写出③中反应的离子方程式为
2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
.
(4)如何判断K
2FeO
4晶体已经洗涤干净
用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净
用试管取少量最后一次的洗涤液,加入硝酸银溶液,无白色沉淀则已被洗净
.
(5)高铁酸钾(K
2FeO
4)与水反应时,生成红褐色胶体的同时释放出一种具有氧化性的气体单质,该气态单质的化学式
O2
O2
,请写出反应的离子方程式:
4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-
4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-
.