
题目列表(包括答案和解析)

| OH- |
| H+ |
| OH- |
| H+ |
| ||
| ||
| ||
| ||
| ||
| ||
铝是一种重要的金属。
(1)铝在元素周期表中的位置是__________。
(2)生产中曾用铝热反应焊接钢轨,铝与氧化铁发生反应的化学方程式为__________________________。
(3)铝与NaOH溶液反应的离子方程式为____________________________;同温同压下,在浓度和体积均为100 mL 2 mol/L的盐酸及NaOH溶液中加入等质量的Al,产生气体的体积比为5∶6,则所加Al的质量为__________。
(4)以上述所得AlCl3溶液为原料制取无水AlCl3,先制得AlCl3·6H2O晶体,主要操作包括________________________,在干燥的HCl气流中加热AlCl3·6H2O晶体,能进一步制取无水AlCl3,其原因是(结合离子方程式简要说明) ______________________。
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示:
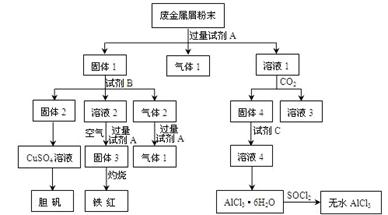
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是 。
(2)溶液2中含有的金属阳离子是 ;气体2的成分是 。
(3)溶液2转化为固体3的反应的离子方程式是 。
(4)固体2制取CuSO4溶液有多种。 如在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是 。
(5)溶液1转化为溶液4的一系列过程,不能简化为“向溶液1中+加试剂C→溶液4”,理由是 。
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是 。
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示: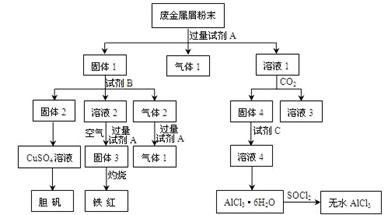
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是 。
(2)溶液2中含有的金属阳离子是 ;气体2的成分是 。
(3)溶液2转化为固体3的反应的离子方程式是 。
(4)固体2制取CuSO4溶液有多种。 如在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是 。
(5)溶液1转化为溶液4的一系列过程,不能简化为“向溶液1中+加试剂C→溶液4”,理由是 。
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是 。
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示:
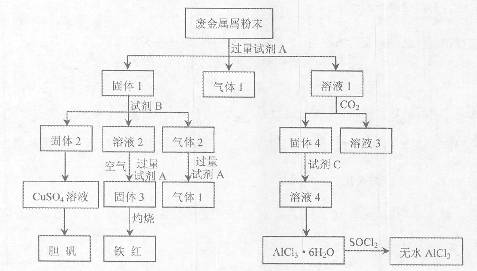
已知: ①Al3+、Al(OH)3、AlO2-有如下转化关系:

②碳酸不能溶解Al(OH)3。
请回答:
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是 。
(2)溶液2中含有的金属阳离子是 ;气体2的成分是 。
(3)溶液2转化为固体3的反应的离子方程式是 。
(4)固体2制取CuSO4溶液有多种方法。
①在固体2中加入浓H2SO4,并加热,使固体2全部溶解得CuSO4溶液,反应的化学方程式是 。
②在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是 。
(5)溶液1转化为溶液4过程中,不在溶液1中直接加入试剂C,理由是 。
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com