
题目列表(包括答案和解析)

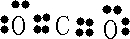
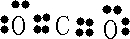
 H++Cl-+HClO
H++Cl-+HClO H++Cl-+HClO
H++Cl-+HClO



 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大下列反应的离子方程式正确的是
| A.将0.1mol·L-1的NH4Al(SO4)2溶液与0.2mol·L-1的Ba(OH)2溶液等体积混合: Al3++2SO42-+2Ba2++4OH-=AlO2-↓+2BaSO4↓+2H2O |
| B.Ca(HCO3)2溶液与少量的NaOH溶液反应: Ca2+ + 2HCO3- +2OH- = CaCO3↓+ CO32- + 2H2O |
| C.向NaClO溶液中通入过量二氧化碳的离子方程式: 2ClO-+CO2+ H2O  |
D.氯气与水反应:Cl2+H2O H++Cl-+HclO H++Cl-+HclO |
在一定条件下发生下列反应,其中属于盐类水解反应的是 ( )
A、NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
B、HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C、HS-+H+=H2S
D、Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
下列离子方程式书写正确的是
A.铜与稀硝酸的反应:Cu+4H++2NO3-= Cu2++2NO2↑+2H2O
B.氯气与水反应:Cl2+H2O H++Cl-+HClO
H++Cl-+HClO
C.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
D.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com