
题目列表(包括答案和解析)
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核只有一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1。
请回答下列问题:

(1)这四种元素中电负性最大的是 (填元素符号)、第一电离能最小的是 (填元素符号) ;
(2)C所在的主族元素气态氢化物中,沸点最低的是 (填化学式);
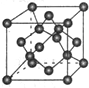
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为 ;
(4)D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是 (填选项序号);

①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:

已知D的硫化物为黑色难溶性物质,请书写第⑤反应的离子方程式: 。
甲 乙 丙 丁
化合物中
各元素原子
个数比 A∶C=1∶1 B∶A=1∶4 D∶E=1∶3 B∶E=1∶4
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E则位于同一周期,且D和E的原子序数之和为30。
(1)D和E同属哪一周期元素?推断依据是什么?
_________________________________________。
_________________________________________。
(2)根据题目提供的条件,推断E在周期表中的族序数所必要的条件是什么?
_________________________________________。
_________________________________________。
(3)向甲的水溶液中加入MnO2,反应的化学方程式
_____________________________________________________________________________。
(4)乙可以燃烧,燃烧时火焰呈蓝色,试写出乙燃烧的化学方程式
_____________________________________________________________________________。(5)D形成的单质在浓硫酸中钝化,而在盐酸中反应生成丙,试解释D在浓硫酸中钝化的原因:
_______________________________________________________________________________
_____________________________________________________________________________。
写出D与盐酸反应生成丙的反应式:
_____________________________________________________________________________。
(6)向3mL1mol×L-1的KI溶液中依次注入下列试剂:①1mL5mol×L-1的盐酸;②0.5mL 30%甲溶液;③1mL丁,经充分振荡后,静置,可得一紫色溶液。这种紫色溶液是什么___________________________________________________________________________________。
有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
甲 乙 丙 丁
化合物中
各元素原子
个数比 A∶C=1∶1 B∶A=1∶4 D∶E=1∶3 B∶E=1∶4
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E则位于同一周期,且D和E的原子序数之和为30。
(1)D和E同属哪一周期元素?推断依据是什么?
_________________________________________。
_________________________________________。
(2)根据题目提供的条件,推断E在周期表中的族序数所必要的条件是什么?
_________________________________________。
_________________________________________。
(3)向甲的水溶液中加入MnO2,反应的化学方程式
_____________________________________________________________________________。
(4)乙可以燃烧,燃烧时火焰呈蓝色,试写出乙燃烧的化学方程式
_____________________________________________________________________________。(5)D形成的单质在浓硫酸中钝化,而在盐酸中反应生成丙,试解释D在浓硫酸中钝化的原因:
_______________________________________________________________________________
_____________________________________________________________________________。
写出D与盐酸反应生成丙的反应式:
_____________________________________________________________________________。
(6)向3mL1mol×L-1的KI溶液中依次注入下列试剂:①1mL5mol×L-1的盐酸;②0.5mL 30%甲溶液;③1mL丁,经充分振荡后,静置,可得一紫色溶液。这种紫色溶液是什么___________________________________________________________________________________。
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 | 熔点/K | 993 | 1539 | 183 |
右图所示为冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种。
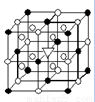
(1)图中●、○分别指代哪种粒子 、 ;大立方体的体心处▽所代表的是 。冰晶石在化工生产中的用途 。
(2)H2S和H2O2的主要物理性质比较如下:[来源:ZXXK]
|
|
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
H2S |
187 |
202[来源:学§科§网Z§X§X§K] |
2.6 |
|
H2O2 |
272 |
423 |
以任意比互溶 |
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因 ?
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
写出铜原子价电子层的电子排布式 ,与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有 (填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有 。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com