
题目列表(包括答案和解析)
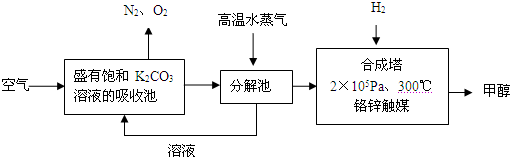
| A、1moLH2完全燃烧生成气态水时所放出的热量,叫做氢气的燃烧热 | B、同温、同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下发生的反应,△H一定不同 | C、水的电离平衡常数、化学平衡常数、难溶电解质的溶度积常数等都随温度的升高而增大. | D、对一个正反应吸热的可逆反应来说,升高温度,正反应速率加快,逆反应也速率加快 |
研究化学反应原理对于生产生活是很有意义的。
(1)下列关于醋酸的叙述正确的是 (填写符号)。
a.醋酸俗名冰醋酸,是食醋的主要成分
b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
c.加水稀释醋酸溶液,溶液中的所有离子浓度均减小
d.常温下,醋酸溶液中水的电离程度减小
(2)牙釉质对牙齿起着保护作用,其主要成分为Ca5(PO4)3OH,该物质在水中存在沉淀溶解
平衡,试写出该物质的溶度积常数表达式Kap= 。
(3)钢铁生锈现象随处可见,钢铁的电化腐蚀原理
如图所示:
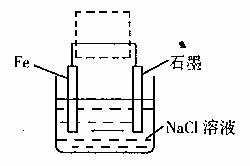
①写出石墨电极的电极反应式 ;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在右图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向。
③写出修改后石墨电极的电极反应式 。
已知25℃时0.1![]() 醋酸溶液的pH值约为3.向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液pH值增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了
醋酸溶液的pH值约为3.向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液pH值增大.对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了![]() ,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使
,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使![]() 减小,因此溶液pH值增大.你认为上述两种解释中________(“甲”或“乙”)正确.
减小,因此溶液pH值增大.你认为上述两种解释中________(“甲”或“乙”)正确.
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1![]() 的醋酸溶液中加入少量下列物质________(填写编号),然后测定溶液的pH值.
的醋酸溶液中加入少量下列物质________(填写编号),然后测定溶液的pH值.
[ ]
A.固体![]()
B.固体![]()
C.气体![]()
D.固体![]()
(2)若________(填“甲”或“乙”)的解释正确,溶液的pH值应________(填“增大”、“减小”或“不变”).
(已知:25℃时,0.1![]() 氨水的电离度为1.3%,0.1
氨水的电离度为1.3%,0.1![]() 醋酸的电离度为1.3%)
醋酸的电离度为1.3%)
|
以下说法错误的是 | |
| [ ] | |
A. |
将pH=4的醋酸稀释后,溶液中所有离子的浓度均减小 |
B. |
pH=11的某物质的水溶液中,对水的电离可能促进也可能是抑制 |
C. |
改变条件使醋酸的电离平衡向右移动,醋酸的电离度可能增大也可能减小 |
D. |
改变条件使醋酸钠溶液中的醋酸根离子浓度增大,溶液的pH可能减小也可能增大 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com