
题目列表(包括答案和解析)

| ||
| ||
 HCO3-+OH-,与油污发生反应,达到去污目的
HCO3-+OH-,与油污发生反应,达到去污目的 HCO3-+OH-,与油污发生反应,达到去污目的
HCO3-+OH-,与油污发生反应,达到去污目的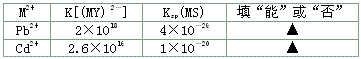
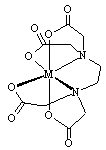
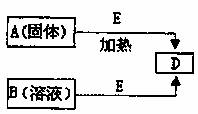
已知A、B、D、E四种物质中均含有同一种短周期元素,D为气体单质,E为黑色粉末,它们有如图所示转化关系(某些产物已略去)。
请回答:
(1)A的化学式为 ;B分子的电子式为 。
(2)已知E与含A中某元素的酸在一定条件下反应,产生一种含该元素的气体X。某化学兴趣小组为研究该气体的性质,设计如图所示装置进行试验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
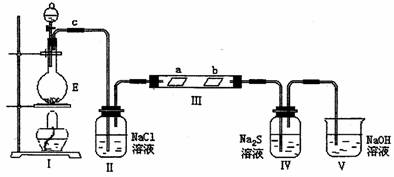
①加入式试剂前,检验气体发生装置I的气密性的操作是:
②写出装置I中发生反应的离子方程式:
③实验过程中,观察到装置IV中出现淡黄色沉淀,其主要反应的离子方程式为:
④实验结束后,该小组同学观察到在装置III中的b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为达到这一预期目的,你认为应对实验装置作如何改进
(3)气体X能与溶液B反应,生成气体D,写出该变化的化学方程式:
已知A、B、D、E四种物质中均含有同一种短周期元素,D为气体单质,E为黑色粉末,它们有如图所示转化关系(某些产物已略去)。
请回答:
(1)A的化学式为 ;B分子的电子式为 。
(2)已知E与含A中某元素的酸在一定条件下反应,产生一种含该元素的气体X。某化学兴趣小组为研究该气体的性质,设计如图所示装置进行试验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
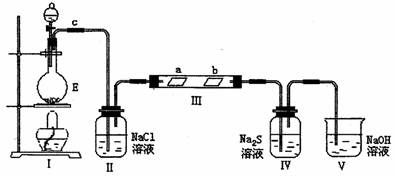
①加入式试剂前,检验气体发生装置I的气密性的操作是:
②写出装置I中发生反应的离子方程式:
③实验过程中,观察到装置IV中出现淡黄色沉淀,其主要反应的离子方程式为:
④实验结束后,该小组同学观察到在装置III中的b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为达到这一预期目的,你认为应对实验装置作如何改进
(3)气体X能与溶液B反应,生成气体D,写出该变化的化学方程式:
(11分)以下是25℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质。例如:
①为了除去氯化铵中的杂质FeCl3,先将混合物溶于水,再加入一定量的试剂充分反应后,过滤结晶即可;
②为了除去氯化镁晶体中的杂质FeCl3,先将混合物溶于水,加人足量的氢氧化镁,充分反应后,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质FeSO4,先将混合物溶于水,加入一定量的酸性H2O2溶液,将Fe2+化成Fe3+后,调升溶液的pH=4后,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为 (填化学式)而除去。
(2)①中加入的试剂应该选择 为宜,其原因是 。
(3)②中除去FeCl3,所发生反应的离子方程式为 。
(4)下列与方案③相关的叙述中,正确的是 (填字母序号)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调升溶液pH=4可选择的试剂是氢氧化铜
D.Cu2+不能大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com