
题目列表(包括答案和解析)








选做题
从以下两道题中任选一道做。
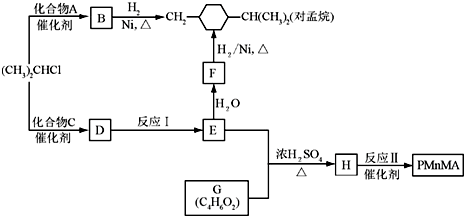
1.光催化制氢是化学研究的热点之一。科学家利用含有吡啶环(吡啶的结构式为![]() ,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):

(1)化合物Ⅱ的分子式为________________________________________。
(2)化合物Ⅰ合成方法如下(反应条件略,除化合物Ⅲ的结构未标明外,反应式已配平):
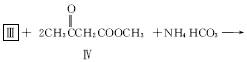
![]()
化合物Ⅲ的名称是_______________________。
(3)用化合物Ⅴ(结构式见下图)代替Ⅲ作原料,也能进行类似的上述反应,所得有机产物的结构式为____________________。

(4)下列说法正确的是________________(填字母)。
A.化合物Ⅴ的名称是间羟基苯甲醛,或2羟基苯甲醛
B.化合物Ⅰ具有还原性;Ⅱ具有氧化性,但能被酸性高锰酸钾溶液氧化
C.化合物Ⅰ、Ⅱ、Ⅳ都可发生水解反应
D.化合物Ⅴ遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
(5)吡啶甲酸酯可作为金属离子的萃取剂。2吡啶甲酸正丁酯(Ⅵ)的结构式见下图,其合成原料2吡啶甲酸的结构式为__________________;Ⅵ的同分异构体中,吡啶环上只有一个氢原子被取代的吡啶甲酸酯类同分异构体有____________________种。

Ⅵ
2.铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为_____________________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列说法正确的是_________________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_____________________。
(5)Cu2O的熔点比Cu2S的______________(填“高”或“低”),请解释原因____________________________。
@@1. (1)C11H13NO4 (2)甲醛
(3)
(4)BC
(5)![]() 12
12
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ▲ ;砷与溴的第一电离能较大的是 ▲ 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 ▲ 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ▲ ,与其互为等电子体的一种分子为 ▲ 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如右图所示。该化合物的分子式为 ▲ ,As原子采取 ▲ 杂化。
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 ▲ 个Ga相连,As与Ga之间存在的化学键有 ▲ (填字母)。
A.离子键 B.σ键 C.π键  D.氢键 E.配位键 F.金属键 G.极性键
D.氢键 E.配位键 F.金属键 G.极性键
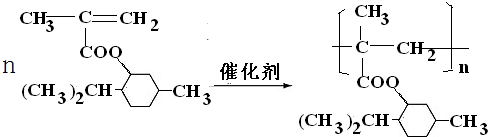
B.某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇。反应原理如下:
有关物质的部分物理性质如下:
| | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯甲醛 | —26 | 179 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲酸 | 122 | 249 | 微溶于水,易溶于乙醇、乙醚 |
| 苯甲醇 | -15.3 | 205.0 | 稍溶于水,易溶于乙醇、乙醚 |
| 乙醚 | -116.2 | 34.5 | 微溶于水,易溶于乙醇 |
 萃取的效果 ▲ (填“好”或“差”)。
萃取的效果 ▲ (填“好”或“差”)。 馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代
馏装置,加热蒸馏并回收乙醚,应选择的加热方法是 ▲ (填字母代 号)。
号)。 冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。
冷却使结晶完全,抽滤,洗涤、干燥。抽滤完毕或中途停止抽滤时,应先 ▲ 。(12分)A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式 ;
(2)B、C、D三种元素电负性由大到小的顺序是 (用元素符号表示);
(3)下列有关上述元素的说法,正确的是 (填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为 ,1 mol B2A4分子中含有 molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是 。
说明:O摄氏度=273K
【解析】原子中没有成对电子只有氢元素,即A是H。基态原子中电子占据三种能量不同的原子轨道,说明这三种轨道分别是1s、2s和2p,又因为每种轨道中的电子总数相同,所以B是C。根据氢化物沸点变化趋势如图可判断,氢化物形成的晶体是分子晶体,但D的最高,沸点是100℃,说明氢化物中含有氢键,且D位于第二周期,故D是O。地壳中含量最高的金属元素是Al,即F是Al。G与F同主族,G的原子序数最大,则G是Ga。由于A、B、C、D、E、F、G的原子序数依次增大,所以C是N。
(1)Al的原子序数是13,所以基态原子的核外电子排布式1S22S22P63S23P1。
(2)电负性是用来描述不同元素的原子对键合电子吸引了的大小,非金属性越强,电负性越大。C、N、O均属于同一周期元素,原子序数逐渐增大,所以非金属性逐渐增强,即电负性大小顺序为O > N > C
(3)氨气中含有氢键所以其沸点高于甲烷的,①不正确。CCl4、苯等有机溶剂均属于非极性分子,根据相似相溶原理可判断Ni(CO)4应为分子晶体,②不正确。氨气分子中的中心原子有4对电子对,其中有1对孤电子对,所以空间构型是三角锥形,采用sp3杂化,③不正确。镁合铝是金属,形成的是金属晶体,金属原子半径越小,金属离子的电荷数越多,金属键越强,所以④正确。比G的原子序数少1的元素是锌,由于锌的核外电子均是全充满,稳定,所以其第一电离能要大于Ga,⑤正确。
(4)在CH2=CH2中含有4个C-H单键和1个碳碳双键,而双键又是又1个σ键和1个 键构成的,所以1mol乙烯中含有5molσ键。
键构成的,所以1mol乙烯中含有5molσ键。
(5)氧化镁和氯化钠均属于离子晶体,形成离子晶体的离子键越强,熔点越高。形成离子键的离子半径越小,离子所带电荷数越多,离子键越强,镁离子半径小于钠离子半径氧离子半径小于氯离子半径,所以氧化镁的熔点高于氯化钠的。
在最新的家用车的调查中发现,现在的家用汽车中的气体质量大都不符合标准,在被调查的不同车型、不同价位的1175辆车中,除了52辆检测合格外,其余都“毒气”超标,超标率从一两倍到七八十倍不等。汽车污染主要来源于汽车配件和材料,操控台、坐椅、车顶毡、脚底垫和所使用的零配件等汽车本身的物件,都会产生大量的有毒气体。根据上述信息,请回答下列问题:
(1)你认为有毒气体含量新车___________(填“高于”或“低于”)旧车;夏天__________(填“高于”或“低于”)冬天。
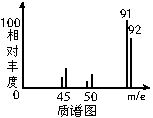
(2)其中一种有毒气体的质谱图如图所示,则由图可知该分子的相对分子质量是_________;若该分子的核磁共振氢谱中有4个吸收峰,则该有机物的名称为____________,其苯环上的一氯代物有__________种。
(3)以上这种物质可以用于制取炸药,请写出制取炸药的化学方程式:__________。
(4)在这些有毒气体中还有一种是以上那种物质的同系物,将一定质量的这种有机物放在氧气中充分燃烧,并将燃烧产物依次通过浓硫酸和碱石灰,分别增重9g和35.2g,则该有机物的分子式为_______________,其同分异构体有___________种,试写出其苯环的一氯代物只有一种时的结构简式____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com