草酸三氢钾是一种无色晶体或白色粉末,加热至100℃失水成无水物,更高温度时分解为碳酸钾和一氧化碳等,溶于水,微溶于醇.实验室有一KH
3(C
2O
4)
2?2H
2O样品(混有一定量的H
2C
2O
4和K
2SO
4).现欲测定其纯度,请回答下列问题:
(1)完成并配平离子反应方程式:
5
5
C
2O
42-+
2
2
MnO
4-+
6
6
H
+=
10
10
CO2↑
CO2↑
+
2
2
Mn
2++
8
8
H
2O
(2)请完成相应的实验步骤:
步骤1:称取35.60g草酸三氢钾试样,加水溶解,配成250mL溶液.
步骤2:用移液管量取两份此溶液各25.00mL,分别置于两个锥形瓶中.
步骤3:第1份溶液加硫酸酸化后,用0.1000mol?L
-1的高锰酸钾溶液滴定,至滴定终点消耗高锰酸钾溶液12.00mL.
步骤4:在第2份溶液中
滴加酚酞试液
滴加酚酞试液
,用0.2500mol?L
-1NaOH溶液滴定,至滴定终点消耗NaOH溶液20mL.
(3)根据(2)中的实验步骤回答:
①步骤1用到的实验仪器有:电子天平、药匙、烧杯、玻璃棒、
250mL容量瓶
250mL容量瓶
、
胶头滴管
胶头滴管
等.
②如何判断步骤3中的滴定终点?
KMnO4最后一滴滴入溶液,溶液恰好变紫红色,且30s内不退色,此时便是滴定终点
KMnO4最后一滴滴入溶液,溶液恰好变紫红色,且30s内不退色,此时便是滴定终点
.
③3.560g试样中含有还原剂(草酸根)的物质的量共为
0.3mol
0.3mol
.样品纯度为
98.1%
98.1%
.
(4)热重分析法(TG)是在程序控制温度下,测量物质的质量与温度的关系的一种实验技术.热重分析仪的基本构造由精密天平、程序控温加热炉和记录仪组成;记录仪画出剩余固体质量(m)~炉温(T)曲线,即热重(TG)曲线图.如图为CaC
2O
4?H
2O在N
2和O
2气氛中的热重曲线.
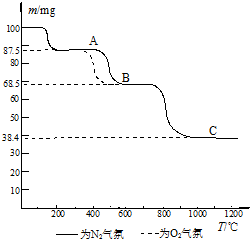
①C点所得固体的化学式为
CaO
CaO
.
②CaC
2O
4?H
2O的分解分三个阶段,由图可看出,第二阶段在O
2气氛中的反应速率要比在N
2气氛中的快,原因是
氧气存在时第2步反应产生二氧化碳会抑制碳酸钙分解反应的进行
氧气存在时第2步反应产生二氧化碳会抑制碳酸钙分解反应的进行
(结合化学方程式回答).










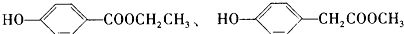 .请写出符合上述条件的其它同分异构体的结构简式
.请写出符合上述条件的其它同分异构体的结构简式










 )
)
