臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如6Ag(s)+O
3(g)=3Ag
2O(s);
△H=-235.8kJ?mol
-1,已知2Ag
2O(s)=4Ag(s)+O
2(g);△H=+62.2kJ?mol
-1,则O
3转化为O
2的热化学方程式为
2O3(g)=3O2(g)△H=-285kJ/mol
2O3(g)=3O2(g)△H=-285kJ/mol
.
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下图所示.
| pH |
3.0 |
4.0 |
5.0 |
6.0 |
| t/min |
| T/℃ |
| 20 |
301 |
231 |
169 |
58 |
| 30 |
158 |
108 |
48 |
15 |
| 50 |
31 |
26 |
15 |
7 |
pH增大能加速O
3分解,表明对O
3分解起催化作用的是
OH-
OH-
.
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景.科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧.臭氧在阳极周围的水中产生,其电极反应式为
3H2O-6e-=O3↑+6H+
3H2O-6e-=O3↑+6H+
;阴极附近的氧气则生成过氧化氢,其电极反应式为
3O2+6H++6e-=3H2O2
3O2+6H++6e-=3H2O2
.
(4)为测定大气中臭氧(O
3)含量,将0℃、1.01×10
5Pa的空气VL慢慢通过足量KI溶液,使臭氧完全反应;然后将所得溶液用amL cmol?L.的Na
2S
2O
3溶液进行滴定恰好到达终点.
①O
3与KI溶液反应生成两种单质,则反应的化学方程式
H2O+O3+2KI═O2+I2+2KOH
H2O+O3+2KI═O2+I2+2KOH
.
②空气中臭氧的体积分数为
.(已知:2Na
2S
2O
3+I
2=Na
2S
4O
6+2NaI)

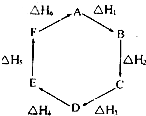 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,如图判断下列关系正确的是( )
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,如图判断下列关系正确的是( )