
题目列表(包括答案和解析)
| ||
| ||
| ||
| ||
| ||
| ||

1.小红查阅到下图资料,图中记录了离某公路不同距离处种植的卷心菜中铅的含量。由该图推测:卷心菜内里叶片的铅可能直接来自于__________,造成卷心菜外围叶片含铅量不同的原因主要是_______________________________________________。

2.在查阅资料时,小红又发现,儿童从空气中吸入的铅量约是成人吸入量的1.6~1.7倍。为了探讨这个现象,她展开了如下研究。利用所学知识完成以下填空。
(1)课题名称为:________________________。
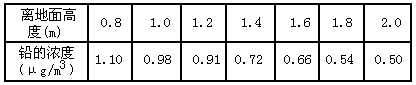
(2)通过取样分析,得到了以下实验数据:
离地面高度(m) | 0.8 | 1.0 | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
铅的浓度(μg/m3) | 1.10 | 0.98 | 0.91 | 0.72 | 0.66 | 0.54 | 0.50 |
分析以上实验数据,可以得出的结果是____________________,造成此结果的原因可能是__________________________________。
3.在走访调查中,小红观察到某乡镇颜料厂排出的废水带有颜色,经鉴定含有铅。为了测定废水中铅的浓度,她设计了如下实验步骤:
废水样品![]() 含Pb2+溶液
含Pb2+溶液![]() PbCrO4沉淀
PbCrO4沉淀![]()
(1)步骤中过滤需要的玻璃仪器是__________、__________和玻璃棒。
(2)步骤中a操作称为__________,缺少此操作,测定结果__________(填“偏高”、“偏低”或“无影响”)。
4.通过研究,小红提出了一系列降低铅对环境污染的建议。下列建议中不恰当的是( )
A.使用无铅汽油
B.开发新的无铅颜料
C.倡导使用铅蓄电池作动力的电动车
D.燃煤电厂、金属冶炼厂的废气经除尘后排放
1.小红查阅到下图资料,图中记录了离某公路不同距离处种植的卷心菜中铅的含量。由该图推测:卷心菜内里叶片的铅可能直接来自于__________,造成卷心菜外围叶片含铅量不同的原因主要是_______________________________________________。

2.在查阅资料时,小红又发现,儿童从空气中吸入的铅量约是成人吸入量的1.6~1.7倍。为了探讨这个现象,她展开了如下研究。利用所学知识完成以下填空。
(1)课题名称为:________________________。
(2)通过取样分析,得到了以下实验数据:
离地面高度(m) | 0.8 | 1.0 | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 |
铅的浓度(μg/m3) | 1.10 | 0.98 | 0.91 | 0.72 | 0.66 | 0.54 | 0.50 |
分析以上实验数据,可以得出的结果是____________________,造成此结果的原因可能是__________________________________。
3.在走访调查中,小红观察到某乡镇颜料厂排出的废水带有颜色,经鉴定含有铅。为了测定废水中铅的浓度,她设计了如下实验步骤:
废水样品![]() 含Pb2+溶液
含Pb2+溶液![]() PbCrO4沉淀
PbCrO4沉淀![]()
(1)步骤中过滤需要的玻璃仪器是__________、__________和玻璃棒。
(2)步骤中a操作称为__________,缺少此操作,测定结果__________(填“偏高”、“偏低”或“无影响”)。
4.通过研究,小红提出了一系列降低铅对环境污染的建议。下列建议中不恰当的是( )
A.使用无铅汽油
B.开发新的无铅颜料
C.倡导使用铅蓄电池作动力的电动车
D.燃煤电厂、金属冶炼厂的废气经除尘后排放
热力学是专门研究能量相互转变过程中所遵循的法则的一门科学。在热力学研究中,为了明确研究的对象,人为地将所注意的一部分物质或空间与其余的物质或空间分开。被划分出来作为研究对象的这一部分称之为体系;而体系以外的其他部分则称之为环境。热化学方程式中的H实际上是热力学中的一个物理量,叫做焓,在化学上表示一个封闭体系中化学反应的能量和对环境所作的功的和。一个体系的焓(H)的绝对值到目前为止还没有办法测得,但当体系发生变化时,我们可以测得体系的焓的变化,即焓变,用“ΔH”表示,ΔH=H(终态)-H(始态)。
(1)化学反应中的ΔH是以 的形式体现的。
对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的ΔH为 0(填“大于”、“小于”),该反应是 (填“放热”、“吸热”)反应;
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101.3 kPa、298 K时,断开1 mol气态AB为气态A、气态B时过程的焓变,用ΔH298(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g) ΔH= 436 kJ?mol-1],形成化学键时ΔH<0[如2H(g)=H2(g) ΔH= - 436 kJ?mol-1]。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH= -185 kJ?mol-1
ΔH298(H2)= 436 kJ?mol-1 ,ΔH298(Cl2)= 247 kJ?mol-1
则ΔH298(HCl)= 。
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH= -25 kJ?mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH= - 47 kJ?mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH= 19 kJ?mol-1
请写出CO还原FeO的热化学方程式:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com