
题目列表(包括答案和解析)
化学概念在逻辑上存在如下图所示关系,对下列概念相互关系的说法正确的是( )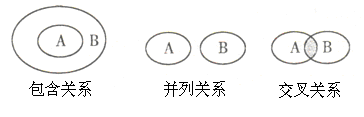
| A.化学键与离子键(或共价键)属于包含关系 |
| B.化合物与电解质属于交叉关系 |
| C.单质与化合物属于交叉关系 |
| D.氧化还原反应与化合反应属于并列关系 |
化学概念在逻辑上存在如下图所示关系,对下列概念相互关系的说法正确的是( )
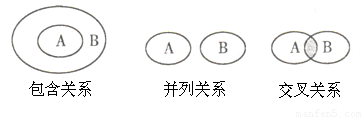
A.化学键与离子键(或共价键)属于包含关系
B.化合物与电解质属于交叉关系
C.单质与化合物属于交叉关系
D.氧化还原反应与化合反应属于并列关系
 H++B(OH)4-,该反应中的碱是
H++B(OH)4-,该反应中的碱是(1)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。目前中学课本中的酸碱理论是1889年阿仑尼乌斯(Arrhenius)提出的电离理论。
①1905年富兰克林(FranKlin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能电离而产生溶剂正离子的物质为酸,凡能电离而产生溶剂负离子的物质为碱。试写出液氨自身电离的方程式: 。
②1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowey)提出质子理论。凡是能够释放质子(氢离子)任何含氢原子的分子或离子都是酸;凡是能够与质子(氢离子)结合的分子或离子都是碱。
按质子理论:下列粒子在水溶液既可以看作酸又可看碱的是 。
A、H2O B、NH4+ C、OH- D、HCO3- E、CH3COO- F、Cl-
③1923年路易斯(Lewis)提出广义的酸碱概念。凡是能给出电子对而形成化学键的物质都是碱;凡是能够和电子对结合的物质都是酸。
酸(电子对接受体)+碱(电子对给予体)→反应产物,如:H++OH-→H2O。
试指出下列两个反应中的酸或碱:
(Ⅰ)H3BO3 +H2O  H++B(OH)4-,该反应中的碱是
(填H3BO3或H2O);
H++B(OH)4-,该反应中的碱是
(填H3BO3或H2O);
(Ⅱ)NaH+H2O ==NaOH+H2↑,该反应中的酸是 (填NaH 或H2O)。
(2)已知A元素原子的K、L层电子数之和比M、L层电子数之和多一个电子;B元素原子核外电子占有9个轨道,且有1个未成对电子;C元素原子核外3p亚层中3个轨道还需5个电子才能达到全充满。D元素只有两个电子层,且最高化合价与最低化合价的代数和为零;E原子半径最小;F元素最外层电子排布为nSnnPn+1。按要求填写
① B的电子排布式是: ,A、B两元素形成的化合物的晶体类型是 。
②D元素单质的晶体类型是 ,C单质的制备方法是: 。
③E和F形成的化合物空间构型为 ,该物质比D与E形成的化合物更容易液化的原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com