
题目列表(包括答案和解析)
(08长沙雅礼中学二模)(14分)I、新能源的开发利用是当今全球的一个重大研究课题,发展氢能源有着广阔的前景,有研究人员提出了“利用太阳能,以水为原料,大量生产氢气,并用作各种机械的动力燃料”这一设想。试回答下列问题:
(1)你认为这一设想能否实现?___________。(填“能”、“不能”)
(2)氢气作为燃料与现在广泛使用的化石燃料相比有什么优点?(要求答出两点)
①__________ _;②__________ 。
(3)燃料电池是一种新型的无污染、无噪音、高效率的发电设备,也是一种很有发展潜力的新能源。在燃料电池中,氢气等燃料在通常条件下就能在电极上进行电极反应(一般用多孔镍、铂等作电极材料).电池中的电解质为有机高分子高聚物,它可以交换质子.
①燃料电池的电极在常温条件下就能持续发生电极反应,写出氢氧燃料电池中的电极反应式:正极____________________________.
②氢氧燃料电池可作为载人航天器的首选电池,除它有作为燃料电池的优点外,还有一个重要原因是__。
II、环境保护是当今世界关注的热点问题。
(1)为了降低汽车尾气对空气的污染,可用纳米级的某种氧化物作催化剂,使尾气中的CO与氮氧化物(NO)反应,转化为空气中含有的两种气体(其中一种为单质),该反应的化学方程式为__________ 。
(2)超临界CO2流体是一种与水相似、能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”。它作为“绿色环保溶剂”的原因之一是:能代替许多有害、有毒、易燃的有机溶剂;之二是_______。
(14分)芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C与其他物质之间的转化如下图所示:
(1)C中含氧官能团的名称是 ;B→A的反应类型是 。
(2)H的结构简式是 。
(3)写出下列化学方程式:
①D与银氨溶液反应___________;②E→I 。
(4)有的同学认为B中可能没有氯原子,你是__________(填“同意”或“不同意”),你的理由_______________。
(5)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有________种,写出其中任意一种同分异构体的结构简式____________。
①属于芳香族化合物
②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: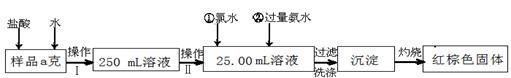
请根据上面流程,回答以下问题:
(1)操作I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有 (填自选仪器名称),操作II 必须用到的仪器是 (从以下选项中选择,填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
(14分)、海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
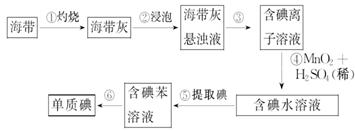
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在横线处)。______________
A.烧杯 B.坩埚 C.表面皿 D.泥三角
E.酒精灯 F.干燥器 G.坩埚钳
(2)步骤③的实验操作名称是______________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是______________。
(3)在步骤④中MnO2 转变为Mn2+ 、I-转变为I2,请写出反应的离子方程式是___________________________________。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是___________________________________;_____________________________________________________________。
(5)、检验提取碘后的水溶液中是否还含有单质碘的试剂是:________________。
(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
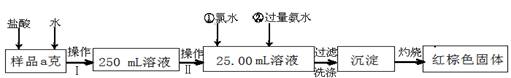
请根据上面流程,回答以下问题:
(1)操作 I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有 (填自选仪器名称),操作 II 必须用到的仪器是 (从以下选项中选择,填编号)。
A.50mL烧杯 B.50mL量筒 C.25mL碱式滴定管 D.25mL酸式滴定管
(2)加入试剂①和②后发生反应的离子反应方程式为:
(3) 将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3 g,则接下来还应进行的操作是____________。
(4) 若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是: 。
(5) 有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是:
(用化学方程式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com