
题目列表(包括答案和解析)

铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子).
根据题意完成:
1、为了制备铁氧体,称取5.6 g铁粉、一定量的FeCl3(s)作为原料,先制备Fe3O4.方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4[已知1 mol Fe(OH)2与2 mol Fe(OH)3混合灼烧可得到1 mol Fe3O4].需要加入FeCl3(s)________ g.
2、如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq)________ mL.
3、在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品.取a克该产品溶于100 mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体.计算:
(1)ag该产品溶于盐酸后,溶液中Fe2+的物质的量浓度(溶液体积变化忽略不计).
(2)推算该产品的化学式(写出推算过程).
4、有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+·Fe3+[Fe3+(1-x)·Cr3+x·O4].向含有1.92 mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688 L(标准状况).计算:(均需写出计算过程)
(1)参加反应的铁氧体的物质的量.
(2)所得气体中NO、NO2的体积比.
铜单质及其化合物是应用极其广泛的物质。
(1)铜是氢后金属,不能与盐酸发生置换反应,但将单质铜置于浓氢碘酸中,会有可燃性气体及白色沉淀生成,又知氧化性:Cu2+>I2,则铜与氢碘酸反应的化学方程式为____________________________________________________。
(2)已知Cu2O能溶于醋酸溶液或盐酸中,同时得到蓝色溶液和红色固体,则Cu2O与稀硫酸反应的离子方程式为____________________________________;
Cu2O与稀硝酸反应的离子方程式为_____________________________;
只用稀硫酸来确定某红色固体是 Cu2O与Cu组成的混合物的方法:称取m g该红色固体置于足量稀硫酸中,充分反应后过滤,然后___________________。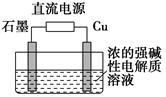
(3)Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解装置如图所示,电解总反应:2Cu+H2O电解,Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
(4)现向Cu、Cu2O、CuO组成的混合物中加入1 L 0.6 mol/L HNO3恰好使混合物溶解,同时收集到2 240 mL NO(标准状况)。若将上述混合物用足量的氢气还原,所得固体的质量为________;若混合物中含有0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗硫酸的物质的量为________。
A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体.甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质.它们之间的转化关系如下图所示:
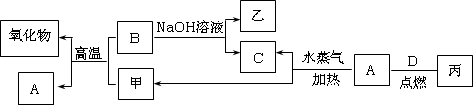
请回答下列问题:
(1)B与甲反应的化学方程式是________.
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解?________(填“是”或“否”).
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是________.
(4)写出A与水蒸气反应生成C和甲的化学方程式________.
(5)将A、B两种金属按一定的质量比组成混合物.
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是________,混合物中B的物质的量为________mol(用含字母的分数式表示).
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为________mol,混合物中A的质量为________g(用含字母的分数式表示).
铁氧体是一类磁性材料,通式为MO· xFe2O3(M为二价金属离子)。
根据题意完成:
(1)为了制备铁氧体,称取5.6g铁粉、一定量的FeCl3(s) 作为原料,先制备Fe3O4。方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4 [ 已知1molFe(OH)2与2molFe(OH)3混合灼烧可得到1mol Fe3O4 ]。需要加入FeCl3(s) g。
(2)如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO· 2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq)
mL。
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取a克该产品溶于100mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+ 全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体。计算:
①ag 该产品溶于盐酸后,溶液中Fe2+ 的物质的量浓度(溶液体积变化忽略不计)。
②推算该产品的化学式(写出推算过程)。
(4)有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+ · Fe3+[ Fe3+(1-x) · Cr3+x · O4]。向含有1.92 mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688 L(标准状况)。计算:(均需写出计算过程)
①参加反应的铁氧体的物质的量。
②所得气体中NO、NO2的体积比。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com