
题目列表(包括答案和解析)

| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释或结论 |
| i | ______ | 棉球变为白色,微热后又恢复红色 | |
| ii | ______ | 棉球变为浅绿色 | 离子方程式:______ 结论:______ |
| iii | Na2S溶液 | 棉球变为浅黄色 | 解释:浅黄色物质是______ 结论:______ |
| iv | ______ | 棉球变为红色 | 化学方程式:______ 结论:该气体属于酸性氧化物 |
 B某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
B某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤Ⅰ:称取0.4g花生油样品,置于两个干燥的碘瓶(如图)内,加入10mL四氯化碳,轻轻摇动使油全部溶解。向碘瓶中加入25.00mL含0.01mol IBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤Ⅱ:在暗处放置30min,并不时轻轻摇动。30min后,小心地打开玻璃塞,用新配制的10%碘化钾10mL和蒸馏水50mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
①![]() +IBr →
+IBr →![]()
②IBr+KI=I2+KBr
③I2+2S2O32-=2I-+S4O62-
请回答下列问题:
⑴已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应用 ▲ ,用方程式表示碘瓶必须干燥的原因 ▲ 。
⑵步骤Ⅱ中碘瓶在暗处放置30min,并不时轻轻摇动的原因是 ▲ 。
⑶步骤Ⅲ中所加指示剂为 ▲ ,滴定终点的现象 ▲ 。
⑷反应结束后从液体混合物中回收四氯化碳,则所需操作有 ▲ 。
某研究小组欲探究SO2的化学性质,设计了如下实验方案。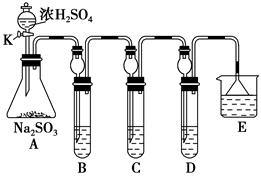
(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为_____________________________________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 | |
| 用另一干净试管取少量沉淀样品,加入______________ | _________________________ |
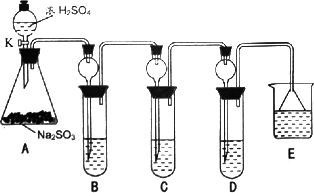
某研究小组欲探究SO2的化学性质,设计了如下实验方案.
(1)
在B中检验S02的氧化性,则B中所盛试剂可为________.(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为________.
(3)在D中装新制某浓溶液.通入SO2-段吋间后,D中出现了大量白色沉淀.同学们对白色沉淀成分进行了探究.请回答下列问题
限选的仪器和试剂;过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1 HCl 0.5 mol·L-1 H2S04 0.5 mol·L-1 BaCl2.品红溶液.新制澄淸石灰水.
(1)所设一:该白色沉淀为CaSO3
假设二:该白色沉淀为________
假设三:该白色沉淀为上述两种物质的混合物.
(ii)基于假设一,填写下表:

(iii)若假设二成立,试写出生成该白色沉淀的化学方程式:________

| O | - 3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com